Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége
lehet.
További kérdéseivel forduljon kezelőorvosához, gyógyszerészéhez vagy a gondozását végző egészségügyi szakemberhez.
Ezt a gyógyszert az orvos kizárólag Önnek írta fel. Ne adja át a készítményt másnak, mert
számára ártalmas lehet még abban az esetben is, ha a betegsége tünetei az Önéhez hasonlóak.
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd
4. pont.
A betegtájékoztató tartalma:
-
Milyen típusú gyógyszer a Xaluprine és milyen betegségek esetén alkalmazható?
-
Tudnivalók a Xaluprine alkalmazása előtt
-
Hogyan kell alkalmazni a Xaluprine-t?
-
Lehetséges mellékhatások
-
Hogyan kell a Xaluprine-t tárolni?
-
A csomagolás tartalma és egyéb információk
-
Milyen típusú gyógyszer a Xaluprine és milyen betegségek esetén alkalmazható?
A Xaluprine merkaptopurint tartalmaz. Ez a gyógyszerek citotoxikumoknak nevezett csoportjába (kemoterápiaként is ismert) tartozik.
A Xaluprine akut limfoblasztos leukémia (vagy más néven akut limfocitás leukémia vagy ALL) esetén alkalmazható. Ez egy gyorsan növekedő betegség, amely során megnő az új fehérvérsejtek száma. Ezek az új fehérvérsejtek éretlenek (nem teljesen érettek), így nem képesek normálisan növekedni és működni. Emiatt nem tudják felvenni a harcot a fertőzésekkel szemben, és vérzést okozhatnak.
Amennyiben erről a betegségről további felvilágosítást szeretne kapni, kérdezze meg kezelőorvosát.
-
Tudnivalók a Xaluprine alkalmazása előtt
Ne alkalmazza a Xaluprine-t, ha allergiás (túlérzékeny) a merkaptopurinra vagy a Xaluprine egyéb összetevőjére (lásd 6. pont).
Ne oltassa be magát sárgaláz elleni védőoltással, miközben Xaluprine-t szed, mert az végzetes
lehet.
Figyelmeztetések és óvintézkedések
A Xaluprine alkalmazása előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel, ha:
sárgaláz elleni védőoltást kapott,
vese- vagy májproblémája van, mert kezelőorvosának ellenőriznie kell azok megfelelő működését.
az Ön szervezete túl kevés TPMT (tiopurin-metiltranszferáz) enzimet termel, mert kezelőorvosának ennek megfelelően módosítania kell az adagján.
gyermekvállalást tervez. Ez férfiakra és nőkre egyaránt vonatkozik. A Xaluprine károsíthatja a hímivarsejteket/petesejteket (lásd alább a „Terhesség, szoptatás és termékenység” szakaszt).
Gyulladásos bélbetegségben szenvedő egyes olyan betegeknél, akik 6-merkaptopurint kaptak, egy ritka és agresszív ráktípus alakult ki, amelyet hepatoszplenikus T-sejtes limfómának hívnak (lásd
4. pont, Lehetséges mellékhatások).
A Xaluprine ne érjen a bőréhez, ne kerüljön a szemébe vagy orrába. Ha véletlenül mégis a szemébe vagy az orrába kerül, vízzel öblítse le a területet.
Ha nem biztos abban, hogy a fentiek bármelyike vonatkozik-e Önre, beszéljen kezelőorvosával vagy gyógyszerészével a Xaluprine alkalmazása előtt.
Gyermekek és serdülők
Gyermekeknél néha előfordult alacsony vércukorszint, különösen hat éves kor alatti, valamint
alacsony testtömegindexszel rendelkező gyermekek esetében. Ha ez bekövetkezik, beszéljen gyermeke kezelőorvosával.
Egyéb gyógyszerek és a Xaluprine
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy a nemrégiben szedett,
valamint a szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható gyógyszereket is. Ez a gyógynövénykészítményekre is vonatkozik.
Különösen akkor tájékoztassa a kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert, ha Ön az alábbiak bármelyikét szedi:
egyéb citotoxikus gyógyszerek (kemoterápia) – Xaluprine készítménnyel együtt alkalmazva nagyobb a mellékhatások, például a vérszegénység kockázata
allopurinol vagy febuxosztát (köszvény kezelésére)
szájon át szedett véralvadásgátlók (a vér hígítására)
olszalazin vagy meszalazin (a fekélyes vastagbélgyulladás nevű bélrendszeri betegség esetén)
szulfaszalazin (krónikus ízületi gyulladás vagy fekélyes vastagbélgyulladás esetén)
epilepsziára szedett gyógyszerek, például fenitoin, karbamazepin. Az epilepszia elleni gyógyszerek vérszintjét monitorozni kell, és az adagolást szükség esetén módosítani kell.
A Xaluprine szedése ideje alatt alkalmazott vakcinák
Ha vakcina beadatására készül, fontos, hogy annak beadása előtt egyeztessen kezelőorvosával vagy a
gondozását végző egészségügyi szakemberrel! Az élő oltóanyagokkal történő oltás (pl. a gyermekbénulás, kanyaró, mumpsz és rubeola elleni védőoltás) nem javasolt, mert ezek megfertőzhetik, ha akkor kapja az oltást, amikor Xaluprine-t szed.
A Xaluprine egyidejű bevétele étellel vagy itallal
A Xaluprine étkezés közben vagy éhgyomorra is bevehető. A kiválasztott mód azonban következetesen alkalmazandó nap mint nap.
Ne vegye be a Xaluprine-t tejjel, illetve tejtermékekkel egyidejűleg, mert ezek ronthatják a készítmény hatásosságát. A Xaluprine-t legalább 1 órával azelőtt, vagy 2 órával azután kell bevenni, hogy tejet vagy tejterméket fogyaszt.
Terhesség, szoptatás és termékenység
Amennyiben gyermekvállalást tervez, ne alkalmazza a Xaluprine-t, előbb kérje ki kezelőorvosa javaslatát! Ez férfiakra és nőkre egyaránt vonatkozik. A Xaluprine károsíthatja a hímivarsejteket vagy
a petesejteket. Megbízható fogamzásgátlást kell alkalmazni a terhesség elkerülése érdekében, miközben Ön vagy partnere Xaluprine-t alkalmaz. A férfiaknak és a nőknek egyaránt hatásos
fogamzásgátló módszert kell alkalmazniuk a kezelés befejezését követően legalább 3 hónapon át. Ha Ön már terhes, mindenképpen beszéljen kezelőorvosával még a Xaluprine alkalmazása előtt!
Jelenleg ellentmondásos információk állnak rendelkezésre a merkaptopurin terhesség alatti biztonságosságáról. Kongenitális (veleszületett) rendellenességekről számoltak be olyan csecsemőknél, akiknek az édesanyját merkaptopurinnal kezelték, különösen egyéb daganatellenes szerekkel kombinációban. Megvan a veszélye a spontán vetélésnek, a koraszülésnek és az alacsony születési súlynak is, ha az édesanyát várandóssága idején merkaptopurinnal kezelték. Egy közelmúltbeli jelentés szerint, amelyben a merkaptopurin alkalmazásának jellemzőit vizsgálták a társadalomban, nem fokozott a koraszülés kockázata, nem túl alacsony a terhesség végére kialakult születési súly, és nem fokozott a veleszületett rendellenességek kockázata sem a terhességük alatt merkaptopurint alkalmazó nőknél.
Terhes, terhességet tervező vagy szoptató nők ne nyúljanak a Xaluprine-hoz.
A Xaluprine alkalmazásának ideje alatt ne szoptasson! Tanácsért forduljon kezelőorvosához, gyógyszerészéhez vagy a szülésznőhöz.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre A Xaluprine várhatóan nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket, de nem végeztek vizsgálatokat ennek alátámasztására.
A Xaluprine aszpartámot, nátrium-metil-parahidroxibenzoátot (E219), nátrium-etil-parahidroxibenzoátot (E215) tartalmaz
A Xaluprine aszpartámot (E951) tartalmaz, ami fenilalanin-forrás. Ez fenilketonuriában szenvedők
esetében káros lehet.
A Xaluprine nátrium-metil-parahidroxibenzoátot (E219) és nátrium-etil-parahidroxibenzoátot (E215) is tartalmaz, amelyek allergiás reakciót okozhatnak (ezek esetleg később jelentkeznek).
Ha kezelőorvosa azt mondta Önnek, hogy bizonyos cukrokkal szemben intoleráns, kérdezze meg kezelőorvosát, mielőtt alkalmazni kezdené ezt a gyógyszert. Károsíthatja a fogakat.
3. Hogyan kell alkalmazni a Xaluprine-t?
A Xaluprine-t csak a vérképzőszervi betegségek kezelésében jártas szakorvos adhatja Önnek.
A Xaluprine alkalmazásának idején kezelőorvosa rendszeres vérvizsgálatot ír majd elő. Ennek célja a vérsejtek számának és típusának ellenőrzése, továbbá a megfelelő májműködés ellenőrzése.
Kezelőorvosa egyéb vér- és vizeletvizsgálatokat is elrendelhet a húgysavszintek nyomon követése érdekében. A húgysav a szervezet természetes vegyülete, amelynek a szintje a Xaluprine alkalmazásának idején megemelkedhet.
Kezelőorvosa e vizsgálatok eredményének birtokában időnként változtathat a Xaluprine adagján.
A gyógyszert mindig a kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét. A szokásos kezdőadag napi 25–75 mg/testfelszín m2 felnőttek, serdülők és gyermekek esetében is. Kezelőorvosa a megfelelő adagot írja fel majd Önnek. Kezelőorvosa olykor változtathat a Xaluprine adagolásán, például bizonyos vizsgálatok eredményeinek birtokában. Ha bizonytalan, hogy mennyi gyógyszert kell bevennie, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert!
Fontos, hogy a Xaluprine-t este vegye be, hogy a gyógyszer jobban hasson.
A gyógyszer bevehető étkezés közben vagy éhgyomorra, de a választott módszert következetesen tartsa be minden nap. A gyógyszerét legalább 1 órával azelőtt, vagy 2 órával azután kell bevennie, hogy tejet vagy tejterméket fogyasztott.
Minden Xaluprine csomag 1 palack gyógyszert, egy kupakot, egy palackadaptert és
2 adagolófecskendőt tartalmaz (1 ml-es lila fecskendő és 5 ml-es fehér fecskendő). Mindig a mellékelt fecskendő segítségével vegye be az adagot.
Fontos, hogy a megfelelő adagolófecskendőt alkalmazza a gyógyszeréhez. Kezelőorvosa vagy gyógyszerésze elmondja majd, melyik fecskendőt alkalmazza az előírt adagtól függően.
A kisebb, 1 ml-es fecskendő (lila), amelyen 0,1 ml és 1 ml közötti beosztásokat talál, az 1 ml-es vagy annál kisebb adagok mérésére szolgál. Ezt a fecskendőt kell használnia akkor, ha az alkalmazandó összmennyiség 1 ml vagy ennél kevesebb (minden 0,1 ml beosztás 2 mg merkaptopurint tartalmaz). A nagyobb, 5 ml-es fecskendő (fehér), amelyen 1 ml és 5 ml közötti beosztásokat talál, az 1 ml-esnél nagyobb adagok mérésére szolgál. Ezt a fecskendőt kell használnia akkor, ha az alkalmazandó összmennyiség több mint 1 ml (minden 0,2 ml beosztás 4 mg merkaptopurint tartalmaz).
Ha Ön a gyógyszer beadásában segédkező szülő vagy gondozó, minden adagolás előtt és után mosson kezet. Azonnal törölje fel, ha a gyógyszer kifröccsent! Az expozíció kockázatának csökkentése érdekében eldobható kesztyűt kell viselnie annak, aki a Xaluprine beadását végzi.
Ha a Xaluprine bőrrel érintkezik, ill. szembe vagy orrba kerül, azonnal és alaposan le kell mosni szappanos vízzel.
A gyógyszer alkalmazásakor kövesse az alábbi utasításokat:
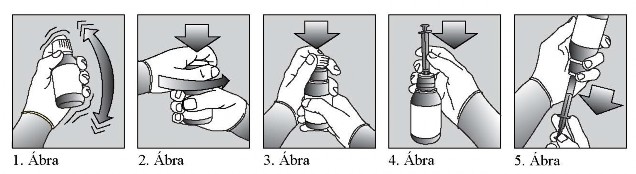
-
Húzzon egyszer használatos kesztyűt, mielőtt a Xaluprine-t kézbe veszi.
-
Az üveget legalább 30 másodpercig rázza erőteljesen, hogy a gyógyszer jól összekeveredjen (1. Ábra).
-
Távolítsa el a palack kupakját (2. Ábra) és határozott mozdulattal nyomja az adaptert a palack tetejéhez, és hagyja is ott későbbi adagolásokhoz (3. Ábra).
-
Nyomja az adagolófecskendő hegyét az adapter nyílásába (4. Ábra). Kezelőorvosa vagy
gyógyszerésze elmondja majd, melyik fecskendőt alkalmazza a helyes adagoláshoz, az 1 ml (lila fecskendő) vagy az 5 ml (fehér fecskendő) térfogatút.
-
Az üveget fordítsa fejjel lefelé (5. Ábra).
-
Húzza vissza a fecskendő dugattyúját, hogy a készítmény a palackból a fecskendőbe kerüljön. Húzza vissza a fecskendő dugattyúját a skála azon pontjáig, amely az előírt adagot mutatja (5. Ábra).
Ha nem biztos benne, hogy mennyi készítményt szívjon fel a fecskendőbe, forduljon tanácsért a
kezelőorvosához vagy a gondozását végző egészségügyi szakemberhez.
-
Fordítsa vissza a palackot az eredeti pozícióba és óvatosan húzza ki a fecskendőt az adapterből, közben pedig a fecskendőt ne a dugattyúnál, hanem inkább a testénél fogva tartsa.
-
Óvatosan helyezze a fecskendő végét a szájába az orca belseje felé irányítva.
-
Lassan és óvatosan nyomja le a dugattyút, hogy a gyógyszert befecskendezze az orca belseje felé, majd nyelje le. NE nyomja erőteljesen a dugattyút, és ne a szájürege hátulsó része vagy a torka felé
fecskendezze a készítményt, mert megfulladhat tőle.
-
Vegye ki a fecskendőt a szájából.
-
Nyelje le a belsőleges szuszpenzió adagját, majd igyon rá egy kis vizet, hogy ne maradjon gyógyszer a szájában.
-
Rakja vissza a palack kupakját úgy, hogy közben az adapter a helyén maradjon. Győződjön meg róla, hogy a kupak jól záródik.
-
Mossa el a fecskendőt meleg szappanos vízzel, majd öblítse jól le. Tartsa a fecskendőt víz alatt és
többször mozgassa a dugattyút fel és le, gondoskodva arról, hogy a fecskendő belseje is tiszta legyen. Hagyja a fecskendőt teljesen megszáradni, mielőtt újból használná. Tartsa a fecskendőt tiszta helyen, a gyógyszerrel együtt.
Minden adagolásnál a kezelőorvosa vagy gyógyszerésze utasításainak megfelelően ismételje a fentieket.
Ha az előírtnál több Xaluprine-t vett be
Ha az előírtnál több Xaluprine-t vett be, tájékoztassa kezelőorvosát vagy menjen azonnal kórházba.
Hányingert érezhet, hányhat és hasmenése is lehet. Vigye magával a gyógyszer csomagolását és ezt a tájékoztatót.
Ha elfelejtette bevenni a Xaluprine-t
Tájékoztassa kezelőorvosát. Ne vegyen be kétszeres adagot a kihagyott adag pótlására.
Ha idő előtt abbahagyja a Xaluprine alkalmazását
Ne hagyja abba a gyógyszer alkalmazását, hacsak kezelőorvosa nem utasítja rá, különben állapota
visszaesést mutathat.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
-
Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ha az alábbi mellékhatások bármelyikét tapasztalja, tájékoztassa szakorvosát vagy menjen azonnal kórházba:
Allergiás reakció, amelynek jelei lehetnek:
bőrkiütés,
magas láz,
ízületi fájdalom,
az arc feldagadása.
A láz vagy fertőzés bármely jele (torokfájás, pállott száj vagy vizeletproblémák);
Bármely váratlan bevérzés vagy vérzés, mert ez arra utalhat, hogy bizonyos típusú vérsejtből nem termelődik elegendő;
Ha hirtelen lesz rosszul (még normális testhőmérséklet mellett is) és fáj a hasa, mert ez hasnyálmirigy-gyulladásra utalhat;
A szemfehérje vagy a bőr besárgulása (sárgaság); Hasmenés.
Beszéljen kezelőorvosával, ha az alábbi mellékhatásokat tapasztalja, mert ennél a gyógyszernél ezek előfordulhatnak.
Nagyon gyakori (10 betegből több mint 1 beteget érint)
fehérvérsejtszám és vérlemezkeszám csökkenése (vérvizsgálatok során észlelhető)
Gyakori (10 betegből kevesebb mint 1 beteget érint)
émelygés (hányinger, hányás)
májkárosodás – vérvizsgálatok során észlelhető
vörösvértestek számának csökkenése, ami miatt fáradtnak, gyengének érezheti magát vagy légszomj jelentkezik (vérszegénység)
étvágytalanság
hasmenés
szájnyálkahártya gyulladása (sztomatitisz)
Nem gyakori (100 betegből kevesebb mint 1 beteget érint)
szájfekélyek
hasnyálmirigy gyulladása
ízületi fájdalom
bőrkiütés
láz
a máj maradandó károsodása (májszövetelhalás)
Ritka (1000 betegből kevesebb mint 1 beteget érint)
hajhullás
férfiaknál: a spermiumok számának átmeneti csökkenése
az arc feldagadása
Nagyon ritka (10 000 betegből kevesebb mint 1 beteget érint)
a kezelttől eltérő, másik típusú leukémia
fekélyek a bélben
Egyéb mellékhatások (a gyakoriságuk ismeretlen)
egy ritka ráktípus (hepatoszplenikus T-sejtes limfóma), (lásd 2. pont, Figyelmeztetések és óvintézkedések)
napfénnyel szembeni túlérzékenység, amely bőrreakciót okoz
További mellékhatások gyermekeknél
Alacsony vércukorszint (hipoglikémia) – gyakorisága ismeretlen.
Ha bármely mellékhatás súlyossá válik, vagy ha a betegtájékoztatóban felsorolt mellékhatásokon kívül egyéb tünetet észlel, kérjük, értesítse kezelőorvosát vagy gyógyszerészét.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V.függelékbentalálhatóelérhetőségekenkeresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
-
Hogyan kell a Xaluprine-t tárolni?
A gyógyszer gyermekektől elzárva tartandó, lehetőség szerint zárható szekrényben. A véletlen lenyelés gyermekek esetében halálos lehet.
A dobozon és a palackon feltüntetett lejárati idő (Felhasználható, Felh.) után ne alkalmazza ezt a
gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Legfeljebb 25°C-on tárolandó.
A palackot tartsa jól lezárva, hogy megakadályozza a készítmény esetleges megromlását és csökkentse a véletlen kifröccsenés kockázatát.
A palack első felnyitása után 56 nappal a fel nem használt mennyiség kidobandó.