Mirvaso 3 mg/g gél
brimonidin
Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos információkat tartalmaz.
-
Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
-
További kérdéseivel forduljon kezelőorvosához.
-
Ezt a gyógyszert az orvos kizárólag Önnek írta fel. Ne adja át a készítményt másnak, mert számára ártalmas lehet még abban az esetben is, ha a betegsége tünetei az Önéhez hasonlóak.
-
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd 4. pont.
A betegtájékoztató tartalma:
-
Milyen típusú gyógyszer a Mirvaso és milyen betegségek esetén alkalmazható?
-
Tudnivalók a Mirvaso alkalmazása előtt
-
Hogyan kell alkalmazni a Mirvaso-t?
-
Lehetséges mellékhatások
-
Hogyan kell a Mirvaso-t tárolni?
-
A csomagolás tartalma és egyéb információk
-
Milyen típusú gyógyszer a Mirvaso és milyen betegségek esetén alkalmazható?
A Mirvaso hatóanyaga a brimonidin, amely a gyakran „alfa agonistáknak” nevezett gyógyszerek csoportjába tartozik.
Az arcbőrön alkalmazandó a rozácea miatt kialakuló bőrpír kezelésére felnőtt betegeknél.
A rozácea miatt bekövetkező bőrpírt az arcbőrben áramló nagy mennyiségű vér okozza, amely a bőrben található vékony hajszálerek kitágulása miatt következik be.
Alkalmazásakor a Mirvaso visszaszűkíti ezeket a hajszálereket, így csökkenti a túl nagy véráramlást és a bőrpírt.
-
Tudnivalók a Mirvaso alkalmazása előtt Ne alkalmazza a Mirvaso-t:
-
ha allergiás a brimonidinre vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
-
2 évesnél fiatalabb gyermekeknél, akik bármely gyógyszer bőrön át történő felszívódásából adódó mellékhatások nagyobb kockázatának lehetnek kitéve.
-
ha a depresszió vagy a Parkinson-kór kezelésére használt bizonyos gyógyszereket szed, amelyek közé tartoznak az úgynevezett monoamino-oxidáz (MAO) gátlók (például a szelegilin vagy moklobemid) vagy a triciklusos antidepresszánsok (úgy mint az imipramin) vagy a tetraciklusos antidepresszánsok (úgy mint a maprotilin, mianszerin vagy a mirtazapin).
-
Ezen gyógyszerek szedése esetén a Mirvaso alkalmazása a vérnyomás csökkenését okozhatja.
Figyelmeztetések és óvintézkedések
A Mirvaso alkalmazása előtt beszéljen kezelőorvosával, ha:
-
arcbőre irritált vagy nyílt seb van rajta.
-
szív- vagy keringési problémái vannak.
-
depresszióban szenved, csökkent az agyhoz vagy a szívhez áramló vér mennyisége, felálláskor leesik a vérnyomása, csökkent a kezében, lábában vagy a bőrében áramló vér mennyisége, vagy Sjögren-szindrómája van (egy krónikus betegség, amelyben a szervezet természetes védekezőrendszere,az immunrendszer, megtámadja a nedveket termelő mirigyeket).
-
vese- vagy májproblémái vannak, vagy korábban voltak.
-
ha bármilyen lézeres kezelést végeztek a bőrén, vagy ilyet terveznek.
Fontos, hogy a kezelést kis mennyiségű géllel kell kezdeni, majd az adag fokozatosan növelhető, de a maximális adagot nem szabad túllépni (lásd: „Hogyan kell alkalmazni a Mirvaso-t?”).
Ne alkalmazza a Mirvaso-t naponta egynél több alkalommal, és ne lépje túl az 1 g (kb. öt borsószemnyi) maximális napi adagot. Lásd még a: „Hogyan kell alkalmazni a Mirvaso-t?” című részben lévő útmutatást.
A bőrpír vagy a kipirulás rosszabbodása, égő érzése:
6 betegből legfeljebb 1 beteg azt tapasztalja, hogy a bőrpír súlyosabban tér vissza, mint amilyen kezdetben volt. A bőrpír ilyen jellegű rosszabbodása általában a Mirvaso-val történő kezelés kezdetétől számított 2 héten belül fordul elő. Ez rendszerint magától megszűnik, ha abbahagyják a kezelést. A legtöbb esetben ennek a hatásnak néhány napon belül fokozatosan el kell múlnia. Mielőtt újból megkezdi a Mirvaso-kezelést, végezzen próbát az arc egy kis területén egy olyan napon, amikor otthon tud maradni. Ha nem tapasztalja a bőrpír rosszabbodását vagy égő érzést, akkor folytassa a kezelést a szokásos módon (lásd 3. pont).
Súlyosbodó vagy nem várt bőrpír esetén hagyja abba a kezelést, és forduljon kezelőorvosához.
Ha a fentiek közül valamelyik igaz Önre, beszéljen kezelőorvosával, mert lehetséges, hogy ez a gyógyszer nem alkalmazható Önnél.
Gyermekek és serdülők
Ne alkalmazza ezt a gyógyszert 18 év alatti gyermekeknél és serdülőknél, mert erre a korcsoportra a gyógyszer biztonságossága és hatásossága nem bizonyított. Ez különösen fontos a 2 év alatti gyermekeknél (lásd a „Ne alkalmazza a Mirvaso-t” c. részt).
Egyéb gyógyszerek és a Mirvaso
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét, a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről, mivel ezek a gyógyszerek befolyásolhatják az Ön Mirvaso-kezelését, vagy pedig a Mirvaso befolyásolhatja az Ön egyéb gyógyszerekkel történő kezelését.
Ne alkalmazza a Mirvaso-t a depresszió vagy a Parkinson-kór kezelésére használható szelegilin, moklobemid, imipramin, mianszerin vagy maprotilin gyógyszerek szedésével egyidejűleg, mert ez a Mirvaso hatásosságát befolyásolhatják, vagy növelhetik a mellékhatások, mint például a vérnyomáscsökkenés esélyeit (lásd a „Ne alkalmazza a Mirvaso-t” c. részt).
Szintén tájékoztassa kezelőorvosát, ha az alábbi gyógyszerek közül valamelyiket szedi:
-
fájdalomcsillapításra, alvászavarok vagy szorongás kezelésére szolgáló gyógyszerek.
-
olyan gyógyszerek, amelyeket pszichiátriai zavarok kezelésére használnak (klórpromazin), hiperaktivitás kezelésére használnak (metilfenidát), vagy magas vérnyomás kezelésére használnak (rezerpin).
-
olyan gyógyszerek, amelyek ugyanazon a testi mechanizmuson hatnak, mint a Mirvaso (egyéb alfa agonisták, pl. klonidin; az úgynevezett alfa blokkolók vagy alfa antagonisták, pl. prazozin, izoprenalin, amelyeket leggyakrabban a magas vérnyomás, alacsony pulzusszám vagy asztma kezelésére használnak).
-
szívglikozidok (pl. digoxin), amelyet szív problémák kezelésére használnak.
-
vérnyomáscsökkentő gyógyszerek úgy, mint a béta blokkolók vagy a kalcium-csatorna blokkolók (pl. propranolol, amlodipin).
Ha a fentiek közül bármelyik igaz Önre, vagy ha bizonytalan valamelyikben, beszéljen kezelőorvosával.
A Mirvaso egyidejű alkalmazása alkohollal
Tájékoztassa kezelőorvosát, ha rendszeresen fogyaszt alkoholt, ugyanis ez befolyásolhatja az Ön ezzel a gyógyszerrel történő kezelését.
Terhesség és szoptatás
Terhesség alatt a Mirvaso alkalmazása nem javallott. Ennek az az oka, hogy a gyógyszer magzatokra gyakorolt hatása nem ismert. Ne alkalmazza a gyógyszert szoptatás alatt.
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre A Mirvaso nem befolyásolja jelentősen a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
A Mirvaso
-
metil-parahidroxibenzoátot tartalmaz, amely (esetleg későbbiekben jelentkező) allergiás reakciót okozhat.
-
propilénglikolt tartalmaz, amely bőrirritációt okozhat.
-
Hogyan kell alkalmazni a Mirvaso-t?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Fontos: A Mirvaso felnőtteknek, és csak az arcbőrön történő alkalmazásra javallott. Ne alkalmazza a gyógyszert más testrészen, különösen nedves testfelszíneken, pl. a szemben, a szájban, az orrban vagy a hüvelyben.
Nem szabad lenyelni!
A Mirvaso gél gyermekektől elzárva tartandó!
Hogyan kell alkalmazni a Mirvaso-t?
A Mirvaso-t csak naponta egyszer ajánlott alkalmazni az arcbőrön.
Az első héten a kezelést kis mennyiségű géllel kell kezdeni, ahogy kezelőorvosa vagy a gondozását végző egészségügyi szakember elmagyarázta Önnek.
Ha a tünetei nem változnak vagy csak kis mértékben javulnak, akkor fokozatosan növelheti a gél mennyiségét. Finoman és egyenletesen, nagyon vékony rétegben oszlassa el, kezelőorvosa vagy a gondozását végző egészségügyi szakember útmutatása szerint. Fontos, hogy ne lépje túl az 1 g maximális napi adagot (összesen öt borsószemnyi mennyiség a teljes arcon).
Ha a Mirvaso géllel történő kezelés során a tünetei rosszabbodnak (fokozódik a bőrpír vagy az égő érzés), hagyja abba a kezelést, és keresse fel kezelőorvosát – lásd még a „Figyelmeztetések és óvintézkedések” című részt.
Kerülje el a szemeket, a szemhéjakat, az ajkakat, a szájat és az orr belsejét. Ha a gél mégis az említett területekre kerül, bő vízzel azonnal öblítse le. Ha a bőrpír erősödik, vagy égő érzés alakul ki, hagyja abba a Mirvaso használatát, és ha szükséges, forduljon kezelőorvosához.
Ne alkalmazzon más, bőrre alkalmazandó gyógyszert vagy kozmetikumot közvetlenül a Mirvaso napi használata előtt. Ezeket a készítményeket csak az alkalmazott Mirvaso megszáradását követően használja. A gyógyszer alkalmazása után azonnal mosson kezet!
Legyen óvatos, amikor legelső alkalommal nyitja ki a tubust / pumpát, nehogy a szükségesnél nagyobb mennyiségű gél jöjjön ki. Ha ez mégis megtörténne, akkor se lépje túl a javasolt adagot, a fölösleges mennyiségű gélt ki kell dobni. Lásd még a „Hogyan kell alkalmazni a Mirvaso-t?” című bekezdést fent.
[EU/1/13/904/001-003]
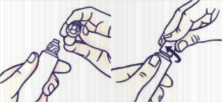
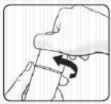
A gyermekbiztonsági záras kupakkal ellátott tubus felnyitása:
Annak érdekében, hogy elkerülje a gyógyszer kifolyását, ne nyomja össze a tubust felnyitáskor és visszazáráskor.
Nyomja le a kupakot, és fordítsa el az óramutató járásával ellentétes irányban (fordítsa el balra egy negyed fordulattal). Ezután húzza le a kupakot.


A gyermekbiztonsági záras kupakkal ellátott tubus visszazárása:
Illessze össze a kupak és a tubus menetét. Nyomja le a kupakot, és fordítsa el az óramutató járásával megegyező irányban (fordítsa el jobbra egy negyed fordulattal).
[EU/1/13/904/004-006]
A gyermekbiztonsági záras kupakkal ellátott tubus felnyitása:
Annak érdekében, hogy elkerülje a gyógyszer kifolyását, ne nyomja össze a tubust felnyitáskor és visszazáráskor.
Nyomja le a kupakot, és fordítsa el az óramutató járásával ellentétes irányban (fordítsa el balra). Ezután húzza le a kupakot.


A gyermekbiztonsági záras kupakkal ellátott tubus visszazárása:
Nyomja le a kupakot, és fordítsa el az óramutató járásával megegyező irányban (fordítsa el jobbra).

[EU/1/13/904/007]
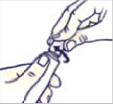
A gyermekbiztonsági záras kupakkal ellátott pumpa felnyitása:
Nyomja le a kupakot, és fordítsa el az óramutató járásával ellentétes irányban (balra), amíg a kupak el nem távolítható.
Figyelem: a kupak levett állapotában a pumpa nem gyermekbiztos.

Az első használat előtt a pumpát többször meg kell nyomni, hogy a gyógyszer kijöjjön az ujjhegyére. A Mirvaso gél arcon történő használatához nyomjon ki a pumpából egy borsószemnyi gélt az ujjhegyére.

|
A pumpa lezárásához helyezze vissza a kupakot a pumpára. Nyomja le a kupakot, és ütközésig fordítsa |
|
el az óramutató járásával megegyező irányban (jobbra). Ezzel a pumpa ismét gyermekbiztos állapotba |
|
|
került. |
|
Ha az előírtnál több Mirvaso-t alkalmazott
Ha 24 órán belül a maximális napi adagot meghaladó adagot alkalmaz, az bőrirritációhoz és egyéb, az alkalmazás helyén fellépő mellékhatásokhoz vezethet. Ismételt dózisok alkalmazása egyazon 24 órás időszak alatt olyan mellékhatások kialakulását eredményezheti, mint az alacsony vérnyomás, az álmosság vagy az aluszékonyság.
Kérjük, forduljon kezelőorvosához, aki elmondja Önnek, mit kell tennie.
A Mirvaso véletlenszerű lenyelése bárkinél, de különösen gyermekek esetében súlyos mellékhatásokhoz vezethet, és kórházi kezelést igényelhet.
Azonnal forduljon kezelőorvosához, vagy haladéktalanul keresse fel egy kórház sürgősségi osztályát, ha Ön, vagy egy gyermek vagy bárki más lenyelte a gyógyszert, és bármit tapasztal az alábbi tünetek közül: szédülés alacsony vérnyomás miatt, hányás, fáradtság vagy álmosság, lassú vagy szabálytalan szívverés, szűk pupillák (pupillaszűkület), nehézlégzés vagy csökkent légzésszám, ernyedtség, alacsony testhőmérséklet vagy görcsök (görcsrohamok). Vigye magával a gyógyszer csomagolását, hogy orvosa tudja, mit nyelt le.
Ha elfelejtette alkalmazni a Mirvaso-t
A Mirvaso hatása az alkalmazás napján tart, a kezelés első napjától kezdve. Ha kihagyja a napi adagot, a bőrpír aznap nem csökken. Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
Ha idő előtt abbahagyja a Mirvaso alkalmazását
Kérjük, keresse fel kezelőorvosát a kezelés abbahagyása előtt.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
-
Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ha súlyos irritáció, kontaktallergia (pl. allergiás reakció, kiütés) vagy szokatlan mellékhatás alakul ki Önnél, hagyja abba a Mirvaso alkalmazását, és keresse fel kezelőorvosát. Egyes esetekben a tünetek kiterjedhetnek a kezelt területen túlra is.
A Mirvaso a következő egyéb mellékhatásokat is okozhatja: Gyakori mellékhatások (10-ből legfeljebb 1 beteget érint):
-
kipirulás
-
túlzott sápadtság a gél alkalmazásának helyén
-
bőrpír, a bőr égő érzése vagy viszketés
Nem gyakori mellékhatások (100-ból legfeljebb 1 beteget érint):
-
pattanás
-
szájszárazság
-
hidegség a kezekben és lábakban
-
melegségérzet
-
fejfájás
-
orrdugulás
-
bőrkiütés, fájdalom vagy kellemetlen érzet a bőrön, bőrirritáció vagy bőrgyulladás, bőrszárazság, bőrmelegség érzet, bizsergés vagy szúró érzés
-
szemhéjduzzanat
-
arcduzzanat
-
csalánkiütés
-
a rozácea rosszabbodása
-
szédülés
Ritka mellékhatások (1000-ből legfeljebb 1 beteget érint):
-
angioödéma (általában az arc, a száj és a nyelv duzzanatával járó súlyos allergiás reakció). Ha ez előfordul, hagyja abba a kezelést
-
hipotenzió (alacsony vérnyomás)
-
lelassult szívverés (alacsony pulzusszám, más néven: bradikardia).
Mellékhatások bejelentése

Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
-
Hogyan kell a Mirvaso-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon, a tubuson és a pumpán feltüntetett lejárati idő (Felhasználható: és Felh.:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Ez a gyógyszer nem igényel különleges tárolást. Nem fagyasztható!
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
-
A csomagolás tartalma és egyéb információk Mit tartalmaz a Mirvaso?
-
A készítmény hatóanyaga a brimonidin. Egy gramm gél 3,3 mg brimonidint tartalmaz, amely megfelel 5 mg brimonidin-tartarátnak.
-
Egyéb összetevők: karbomer, metil-parahidroxibenzoát (E218), fenoxietanol, glicerin,
titán-dioxid, propilénglikol, nátrium-hidroxid, tisztított víz. A metil-parahidroxibenzoátra és a propilénglikolra vonatkozó információkat a 2. pont végén olvashatja.
Milyen a Mirvaso külleme és mit tartalmaz a csomagolás?
A Mirvaso fehér vagy halványsárga színű, opálos gél. 2, 10 vagy 30 gramm gélt tartalmazó tubusban vagy 30 gramm gélt tartalmazó légzáró pumpában kapható.
Egy csomag 1 tubust vagy 1 pumpát tartalmaz.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A forgalomba hozatali engedély jogosultja és a gyártó
A forgalomba hozatali engedély jogosultja Galderma International
Tour Europlaza, 20 avenue André Prothin – La Défense 4 La Défense Cedex 92927
Franciaország
Gyártó
Laboratoires Galderma
Z.I. Montdésir
74540 Alby-sur-Chéran Franciaország
és
Galderma Laboratorium GmbH Georg-Glock-Str. 8
D-40474 Düsseldorf Németország
A készítményhez kapcsolódó további kérdéseivel forduljon a forgalomba hozatali engedély jogosultjának helyi képviseletéhez:
Österreich
Galderma Austria GmbH Tel: 0043 732 715 993
e-mail: austria@galderma.com
Italia
Galderma Italia S.p.A. Tel: + 39 039 63 4691
België/Belgique/Belgien Luxembourg/Luxemburg Galderma Benelux BV Tél./Tel: +31 183691919
e-mail: info.be@galderma.com
Latvija
H. Abbe Pharma GmbH Tel: +371/67/103205
e-mail: birojs.habbe@apollo.lv
????????
????? ???? ???
?????, ??.“??????????“9, ??.3 ???.: + 359 2 962 15 26
e-mail: office@elanapharm.com
Lietuva
H. Abbe Pharma GmbH atstovybe Tel: +370/52/711710
e-mail: info@abbepharma.lt
Česká republika Slovenská republika
Galderma-Spirig Česká a Slovenská republika a.s. Tel: +421 2 49 10 90 10e-mail: czsk@galderma.com
Magyarország
Ewopharma Hungary Kft.
Tel.: +36 1 200 4650
e-mail: info@ewopharma.hu
Danmark Norge Ísland
Suomi/Finland Sverige
Galderma Nordic AB Tlf/Sími/Puh/Tel: + 46 18 444 0330 e-mail: nordic@galderma.com
Malta
Prohealth Limited
Tel. +356 21461851, +356 21460164
e-mail: info@prohealth.com.mt
Deutschland
Galderma Laboratorium GmbH Tel: + 49 (0) 800 – 5888850
e-mail: patientenservice@galderma.com
Nederland
Galderma Benelux BV Tel: + 31 183691919
e-mail: info.nl@galderma.com
Eesti
H. Abbe Pharma GmbH Tel: + 372/6/460980
e-mail: info@habbepharma.ee
Polska
Galderma Polska Sp. z o.o.
Tel.: + 48 22 331 21 80
e-mail: info.poland@galderma.com
?????? ??????
Galderma ????? ?.?.
???: + 30 210 81 04 190
e-mail: galderma.hellas@galderma.com
Portugal
Laboratorios Galderma, SA – Sucursal em Portugal
Tel: + 351 21 315 19 40
e-mail: galderma.portugal@galderma.com
Espana
Laboratorios Galderma SA Tel: + 34 902 02 75 95
e-mail: RegulatorySpain@galderma.com
România
NEOLA PHARMA Tel: + 40 21 233 17 81
e-mail: office@neolapharma.ro
France
Galderma International Tél: + 33 (0)8.20.20.45.46
e-mail: pharmacovigilance.france@galderma.com
Slovenija
Medical Intertrade d.o.o. T: +386 1 2529 113
F: +386 1 2529 114
e-mail: info@medical-intertrade.si
Hrvatska
Medical Intertrade d.o.o.
T: +385 1 333 6036
e-mail : registracije@medical-intertrade.hr
United Kingdom Ireland
Galderma (UK) Ltd.
Tel: + 44 (0) 1923 208950
A betegtájékoztató legutóbbi felülvizsgálatának dátuma: XXXX. hónap
A gyógyszerről részletes információ az Európai Gyógyszerügynökség internetes honlapján (http://www.ema.europa.eu/) található.
MELLÉKLET
Tudományos következtetések
Figyelembe véve a Farmakovigilancia Kockázatértékelő Bizottságnak (PRAC) a brimonidinre (csak a centralizáltan engedélyezett készítmény) vonatkozó időszakos gyógyszerbiztonsági jelentéseket (PSUR) értékelő jelentését, a CHMP a következő tudományos következtetésekre jutott:
A Mirvaso szisztémás alfa-2-adrenerg hatásaként kialakuló bradycardia nagyon valószínű az ehhez elegendő mennyiségű szisztémás felszívódás esetén. Összesen 6, bradycardiával összefüggésbe hozható bejelentés érkezett, és bár néhány esetben vannak zavaró tényezők, a bizonyítékok összességében a Mirvaso és a bradycardia kialakulása közötti összefüggésre utalnak, különösen gyulladt bőrön történő alkalmazás esetén. Ezt az összefüggést alátámasztja a korábban nemkívánatos eseményként azonosított hypotensio is, mivel az alfa-2 adrenerg stimulációnál várható mindkét hatás fellépése. Ezért a PRAC az Alkalmazási előírás 4.8 pontjának módosítását kezdeményezte, hozzáadva a „bradycardia” mellékhatást „Ritka” gyakorisággal.
A szédülés a már felsorolt „hypotensio” nemkívánatos esemény gyakori tünete is. Összesen 37, forgalomba hozatal utáni bejelentés érkezett szédülés preferált kifejezésként, és a jelen gyógyszerbiztonsági jelentésben a brimonidin valószínűsíthető alfa-2-adrenerg hatására utaló hemodinámiás hatás kategóriában tárgyalt 18 kumulatív esetből 9-nél számoltak be szédülés előfordulásáról. A PRAC véleménye szerint a bizonyítékok a brimonidin gél és a szédülés közötti okozati kapcsolatra utalnak, ezért a PRAC az Alkalmazási előírás 4.8 pontjának módosítását kezdeményezte, hozzáadva a „szédülés” mellékhatást „Nem gyakori” gyakorisággal.
A brimonidin alfa-2-adrenerg hatására utaló 18 vizsgált eset közül 6 jelentkezett a Mirvaso friss lézerkezelést követő alkalmazásakor, és 1 bradycardia esetet hoztak összefüggésbe a napégést szenvedett bőrön való alkalmazással. Biológiai szempontból valószínűsíthető, hogy a gyulladt bőrön keresztül történő nagyobb fokú szisztémás felszívódás növelheti a szisztémás hemodinámiás hatások kialakulásának kockázatát. Ezért, bár a kapcsolat teljes bizonyossággal nem igazolható, a rendelkezésre álló bizonyítékok alátámasztják a Mirvaso friss lézerkezelést követő alkalmazása és a hemodinámiás nemkívánatos események kialakulása közötti összefüggést. Ezért a PRAC az Alkalmazási előírás 4.4 pontjának módosítását kezdeményezte, hozzáadva a lézerkezelés utáni alkalmazásra vonatkozó figyelmeztetést.
Ezért az áttekintett gyógyszerbiztonsági jelentésben bemutatott adatok ismeretében a PRAC úgy ítélte meg, hogy a brimonidint tartalmazó gyógyszerek kísérőiratainak módosítása indokolt.
A CHMP egyetért a PRAC tudományos következtetéseivel.
A forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
A brimonidinre (csak a centralizáltan engedélyezett készítményre) vonatkozó tudományos következtetések alapján a CHMP-nek az a véleménye, hogy a brimonidin hatóanyagot (csak a centralizáltan engedélyezett készítményeket) tartalmazó gyógyszer(ek) előny-kockázat profilja változatlan, feltéve, hogy a kísérőiratokban a javasolt módosításokat elvégzik.
A CHMP a forgalomba hozatali engedély(ek) feltételeinek a módosítását javasolja.




![]()





