okrelizumab
![]() Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Ehhez Ön is hozzájárulhat a tudomására jutó bármilyen mellékhatás bejelentésével. A mellékhatások jelentésének módjairól a 4. pont végén (Mellékhatások bejelentése) talál további tájékoztatást.
Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Ehhez Ön is hozzájárulhat a tudomására jutó bármilyen mellékhatás bejelentésével. A mellékhatások jelentésének módjairól a 4. pont végén (Mellékhatások bejelentése) talál további tájékoztatást.
Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
További kérdéseivel forduljon kezelőorvosához.
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd 4. pont
Milyen típusú gyógyszer az Ocrevus és milyen betegségek esetén alkalmazható?
Tudnivalók az Ocrevus alkalmazása előtt
Hogyan kell alkalmazni az Ocrevus-t?
Lehetséges mellékhatások
Hogyan kell az Ocrevus-t tárolni?
A csomagolás tartalma és egyéb információk
Az Ocrevus hatóanyaga az okrelizumab. Ez egyfajta fehérje, úgynevezett „monoklonális antitest”. Az antitestek úgy fejtik ki a hatásukat, hogy a szervezetben meghatározott célpontokhoz kapcsolódnak.
Az Ocrevus felnőttek esetében a következő betegségek kezelésére alkalmazható:
A szklerózis multiplex relapszáló formái
Korai elsődleges progresszív szklerózis multiplex
A szklerózis multiplex a központi idegrendszert, különösen az agyban és a gerincvelőben lévő idegeket érinti. Szklerózis multiplexben az immunrendszer (a test védekező rendszere) nem megfelelően működik, megtámadja az idegsejteket körülvevő védőburkot (az ún. mielinhüvelyt) és gyulladást okoz. A mielinhüvely lebomlása következtében károsodik az idegek megfelelő működése.
A szklerózis multiplex tüneteit az határozza meg, hogy a központi idegrendszer melyik része érintett, így a tünetek között lehetnek járási és egyensúlyi problémák, gyengeség, zsibbadás, kettős látás vagy homályos látás, koordinációs zavar és húgyhólyag-problémák.
Az Ocrevus a fehérvérsejtek egyik típusához, bizonyos B-sejtekhez kapcsolódik. Ezek a sejtek az immunrendszer részét képezik, és szerepet játszanak a szklerózis multiplex kialakulásában. Az Ocrevus ezeket a bizonyos B-sejteket célozza meg és távolítja el. Ez csökkenti a gyulladást és a mielinhüvely károsodását, csökkenti a relapszus előfordulásának valószínűségét és lassítja a betegség rosszabbodását.
ha allergiás az okrelizumabra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére
ha jelenleg fertőzése van
ha úgy tájékoztatták, hogy súlyos immunrendszeri problémái vannak
ha daganatos megbetegedésben szenved
Ha nem biztos ebben, akkor az Ocrevus beadása előtt beszéljen kezelőorvosával.
Önnek fertőzése van. Kezelőorvosa megvárja, amíg a fertőzés elmúlik, mielőtt Ön Ocrevus-t kapna.
Önnek valaha volt hepatitisz B fertőzése, vagy Ön hepatitisz B vírushordozó. Ennek az az oka, hogy az Ocrevushoz hasonló gyógyszerek hatására a hepatitisz B vírus újra aktiválódhat. Az Ocrevus-kezelés előtt kezelőorvosa ellenőrizni fogja, hogy Önnél fennáll-e a hepatitisz B fertőzés kialakulásának veszélye. Azoknál a betegeknél, akiknek már volt hepatitisz B fertőzésük vagy hepatitisz B vírushordozók, vérvizsgálatot fognak végezni, és egy orvos figyelemmel fogja kísérni őket a hepatitisz B fertőzés jeleinek észlelése céljából.
Ön daganatos betegségben szenved, vagy a múltban volt daganatos betegsége. Kezelőorvosa dönthet úgy, hogy későbbre halasztja az Ocrevus-kezelést.
Infúziós reakciók
Az Ocrevus-kezelés leggyakoribb mellékhatása az infúziós reakciók előfordulása.
Az infúziós reakció kockázatának csökkentése érdekében kezelőorvosa egyéb gyógyszereket fog adni Önnek minden Ocrevus infúzió előtt (lásd 3. pont), továbbá az infúzió beadása alatt és utána még legalább egy órán át szoros megfigyelés alatt fogják Önt tartani.
Fertőzések
Az Ocrevus-kezelés megkezdése előtt beszéljen kezelőorvosával, ha úgy gondolja, hogy fertőzése van. Kezelőorvosa meg fogja várni a fertőzés megszűnését, mielőtt Ocrevus-t adna Önnek.
Az Ocrevus-kezelés alatt könnyebben kaphat fertőzéseket. Ez azért van, mert az Ocrevus által megcélzott immunsejtek is szerepet játszanak a fertőzések leküzdésében.
Az Ocrevus-kezelés megkezdése és a további infúziók előtt kezelőorvosa arra kérheti Önt, hogy végeztessen vérvizsgálatot immunrendszere ellenőrzése céljából, mert immunrendszere súlyos problémái esetén gyakrabban fordulhatnak elő fertőzések.
Ha Önt elsődleges progresszív szklerózis multiplex miatt Ocrevus-szal kezelik és nyelési nehézségei vannak, az Ocrevus növelheti a súlyos tüdőgyulladás kockázatát.
láz vagy hidegrázás
nem múló köhögés
herpesz (például ajakherpesz, övsömör vagy a nemi szerveket érintő herpesz).
Oltások
Tájékoztassa kezelőorvosát, ha nemrégiben bármilyen oltást kapott, vagy a közeljövőben oltást terveznek Önnél.
Az Ocrevus-kezelés alatt olyan oltóanyagokat, melyek élő vagy élő, legyengített kórokozókat tartalmaznak (például a tuberkulózis elleni BCG vagy sárgaláz elleni oltás) nem kaphat. Nem ismert, hogy az Ocrevus hogyan befolyásolhatja az egyéb típusú oltóanyagokra adott válaszreakciót.
Kezelőorvosa ellenőrizni fogja, hogy szüksége van-e valamilyen oltásra, mielőtt az
Ocrevus-kezelést megkezdi. Minden oltást legalább 6 héttel az Ocrevus-kezelés megkezdése előtt be kell adni.
Az Ocrevus gyermekeknél és 18 évesnél fiatalabb serdülőknél nem alkalmazható. Ennek az az oka, hogy ebben a korcsoportban még nem vizsgálták.
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Különösen akkor tájékoztassa kezelőorvosát, ha:
valaha olyan gyógyszereket szedett, szed vagy tervez szedni, amelyek hatással vannak az immunrendszer működésére – például kemoterápia, immunszuppresszív szerek vagy a szklerózis multiplex kezelésére alkalmazott egyéb gyógyszerek. Ezeknek a gyógyszereknek az immunrendszerre gyakorolt hatása az Ocrevus-szal együtt túlságosan erős lehet. Kezelőorvosa dönthet úgy, hogy későbbre halasztja az Ocrevus-kezelést, vagy javasolhatja Önnek, hogy az Ocrevus-kezelés megkezdése előtt hagyja abba ezeknek a gyógyszereknek az alkalmazását.
Ha a fentiek bármelyike vonatkozik Önre (vagy nem biztos ebben), akkor az Ocrevus beadása előtt beszéljen kezelőorvosával.
Ha Ön terhes, illetve fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, az Ocrevus alkalmazása előtt beszéljen kezelőorvosával. Ez azért fontos, mert az Ocrevus átjuthat a méhlepényen és hatással lehet gyermekére.
Az Ocrevus nem alkalmazható terhesség alatt, kivéve, ha ezt megbeszélte a kezelőorvosával. Kezelőorvosa mérlegelni fogja az Ocrevus-kezelés előnyeit, és az Ön gyermekét érintő kockázatot.
Ha Ön teherbe eshet (fogamzóképes), akkor fogamzásgátlást kell alkalmaznia:
az Ocrevus-kezelés alatt és
az utolsó Ocrevus infúzió után még 12 hónapig.
Az Ocrevus-kezelés alatt nem szoptathat. Ennek az az oka, hogy az Ocrevus bekerülhet az anyatejbe.
Nem ismert, hogy az Ocrevus befolyásolja-e a gépjárművezetéshez és a gépek, eszközök kezeléséhez szükséges képességeket.
Kezelőorvosa tájékoztatni fogja Önt, hogy a szklerózis multiplex betegsége befolyásolhatja-e a
gépjárművezetéshez vagy az eszközök és gépek biztonságos kezeléséhez szükséges képességeit.
Ez a gyógyszer adagonként kevesebb mint 1 mmol nátriumot (23 mg) tartalmaz, azaz lényegében nátriummentes.
Az Ocrevus-t egy olyan orvos vagy egészségügyi szakember fogja beadni Önnek, aki tapasztalatokkal rendelkezik a kezelés alkalmazásában. Szoros megfigyelés alatt fogják tartani Önt a gyógyszer beadása során. Erre a mellékhatások felismerése érdekében van szükség. Az Ocrevus-t Ön minden esetben cseppinfúzió formájában (intravénás infúzióban) fogja kapni.
Mielőtt beadják Önnek az Ocrevus-t, egyéb gyógyszereket fog kapni a lehetséges mellékhatások, például az infúziós reakciók megelőzésére vagy csökkentésére (az infúziós reakciókkal kapcsolatos információkat lásd a 2. és a 4. pontban).
Minden infúzió előtt egy kortikoszteroidot és egy antihisztamint fog kapni, illetve kaphat lázcsillapítókat is.
Az Ocrevus-t egy orvos vagy a gondozását végző egészségügyi szakember fogja beadni Önnek. Az infúziót vénába adják be (intravénás infúzió vagy „iv.” infúzió).
Az Ocrevus infúzió beadása alatt és azt követően még legalább 1 órán át szoros megfigyelés alatt fogják Önt tartani. Ez azért szükséges, hogy megfigyeljék, jelentkeznek-e Önnél mellékhatások, például infúziós reakciók. Ha Önnél infúziós reakció alakul ki, akkor a súlyosságától függően az infúziót lelassíthatják, átmenetileg felfüggeszthetik vagy véglegesen leállíthatják (az infúziós reakciókkal kapcsolatos információkat lásd a 2. és a 4. pontban).
Ön 6 havonta fog egy 600 mg-os teljes Ocrevus adagot kapni.
Az Ocrevus első 600 mg-os adagját 2 külön infúzióban (egyenként 300 mg) fogják beadni 2 hét különbséggel. Mindegyik infúzió beadása körülbelül 2 és fél órán át fog tartani.
Az Ocrevus következő 600 mg-os adagjait egyszeri infúzióban fogják beadni. Mindegyik infúzió beadása körülbelül 3 és fél órán át fog tartani.
Ha kihagy egy Ocrevus infúziót, beszéljen kezelőorvosával annak érdekében, hogy minél előbb megszervezhesse annak beadását. Ne várjon a következő tervezett infúzióig.
Ahhoz, hogy az Ocrevus a lehető leghatékonyabb legyen, fontos, hogy minden infúziót az esedékes időpontban kapjon meg.
Fontos, hogy addig folytassa a kezelését, amíg Ön és kezelőorvosa úgy ítéli meg, hogy az
előnyös az Ön számára.
Egyes mellékhatások összefüggésben lehetnek a B-sejtek alacsony számával. Az
Ocrevus-kezelés befejezése után még mellékhatásokat tapasztalhat, amíg a B-sejtek szintje vissza nem tér a normálértékre. A B-sejtek vérszintje fokozatosan vissza fog térni a normálértékre. Ez hat hónaptól két és fél évig tarthat, vagy ritka esetekben akár több évig.
Mielőtt elkezd más gyógyszereket szedni, tájékoztassa kezelőorvosát arról, hogy mikor kapta az utolsó Ocrevus infúziót.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát.
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Az Ocrevus-kezeléssel összefüggésben az alábbi mellékhatásokat jelentették:
Az Ocrevus-kezelés leggyakoribb mellékhatása az infúziós reakció (nagyon gyakori: 10-ből több mint 1 beteget érinthet). Az esetek többségében ezek enyhe reakciók, de néhány súlyos reakció is előfordulhat.
bőrviszketés
kiütés
csalánkiütés
bőrvörösödés
torokirritáció vagy torokfájás
légszomj
torokduzzanat
kipirulás
alacsony vérnyomás
láz
fáradtság érzés
fejfájás
szédülés
émelygés (hányinger)
szapora szívverés.
Ha Önnél infúziós reakció lép fel, gyógyszereket fog kapni ennek kezelésére, és lehetséges, hogy az infúziót le kell lassítani vagy le kell állítani. A reakció megszűnése után az infúzió folytatható. Ha az infúziós reakció életveszélyes, kezelőorvosa végleg le fogja állítani az Ön Ocrevus-kezelését.
Az Ocrevus-kezelés alatt könnyebben kaphat fertőzéseket. Az alábbi fertőzéseket figyelték meg Ocrevus-szal kezelt szklerózis multiplexben szenvedő betegek esetében.
felső légúti fertőzés
influenza.
arcüreggyulladás
hörghurut (a hörgő gyulladása)
herpesz fertőzés (ajakherpesz vagy övsömör)
gyomor- és bélfertőzés (gasztroenteritisz)
légúti fertőzés
vírusos fertőzés
bőrfertőzés (cellulitisz)
Ezek közül néhány súlyos is lehet.
láz vagy hidegrázás
nem múló köhögés
herpesz (például szájherpesz, övsömör vagy a nemi szerveken jelentkező herpesz).
a fertőzések elleni védelemben segítséget nyújtó bizonyos fehérjék (immunglobulinok) szintjének csökkenése a vérben
köhögés
sűrű váladék felhalmozódása az orrban, a torokban vagy a mellkasban
a fehérvérsejtek egy fajtájának alacsony szintje (neutropenia).
![]()
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
Az Ocrevus-t az alábbi körülmények között fogja az egészségügyi szakember tárolni a kórházban vagy a klinikán:
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és az injekciós üveg címkéjén feltüntetett lejárati idő (Felh.:) után ne alkalmazza a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 oC – 8 oC) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében az injekciós üvegeket tartsa a dobozban.
Az Ocverust a beadás előtt hígítani kell. A hígítást egészségügyi szakember fogja elvégezni. A készítményt közvetlenül a hígítást követően ajánlatos felhasználni. Ha nem használják fel azonnal, az egészségügyi szakember a felelős az elkészített oldat tárolási idejére és a felhasználást megelőző tárolási körülményekre vonatkozó előírások betartásáért; és az oldat legfeljebb 24 órán át tárolható
2 C-8 C közötti hőmérsékleten, és további 8 órán át szobahőmérsékleten.
Semmilyen gyógyszert ne dobjon a szennyvízbe. Ezek az intézkedések elősegítik a környezet védelmét.
Hatóanyaga az okrelizumab. Injekciós üvegenként 300 mg okrelizumabot tartalmaz 10 ml
oldatban, 30 mg/ml koncentrációban.
Egyéb összetevők: nátrium-acetát-trihidrát, jégecet, trehalóz-dihidrát, poliszorbát 20 és injekcióhoz való víz.
Az Ocrevus tiszta vagy enyhén opálos, színtelen vagy halvány barna oldat.
A gyógyszer koncentrátum oldatos infúzióhoz formában kerül forgalomba.
Ez a gyógyszer 1 vagy 2 injekciós üveget (10 ml koncentrátum injekciós üvegenként) tartalmazó csomagolásban kapható. Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Roche Registration Limited 6 Falcon Way
Shire Park
Welwyn Garden City AL7 1TW
Egyesült Királyság
Roche Pharma AG Emil-Barell-Strasse 1
D-79639 Grenzach-Wyhlen Németország
A készítményhez kapcsolódó további kérdéseivel forduljon a forgalomba hozatali engedély jogosultjának helyi képviseletéhez:
|
België/ Belgique /Belgien N.V. Roche S.A. Tél/Tel: +32 (0) 2 525 82 11 |
Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
|
???????? ??? ???????? ???? ???: +359 2 818 44 44 |
Luxembourg/Luxemburg (Voir/siehe Belgique/Belgien) |
|
Česká republika Roche s. r. o. Tel: +420 - 2 20382111 |
Magyarország Roche (Magyarország) Kft. Tel: +36 - 23 446 800 |
|
Danmark Roche a/s Tlf: +45 - 36 39 99 99 |
Malta (lásd Egyesült Királyság) |
|
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 |
Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
|
Eesti Roche Eesti OÜ Tel: + 372 - 6 177 380 |
Norge Roche Norge AS Tlf: +47 - 22 78 90 00 |
|
?????? Roche (Hellas) A.E. ???: +30 210 61 66 100 |
Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
|
Espana Roche Farma S.A. Tel: +34 - 91 324 81 00 |
Polska Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88 |
|
France Roche Tél: +33 (0) 1 47 61 40 00 |
Portugal Roche Farmaceutica Química, Lda Tel: +351 - 21 425 70 00 |
|
Hrvatska Roche d.o.o. Tel: +385 1 4722 333 |
România Roche România S.R.L. Tel: +40 21 206 47 01 |
|
Ireland Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700 |
Slovenija Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00 |
|
Ísland Roche a/s c/o Icepharma hf Sími: +354 540 8000 |
Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
|
Italia Roche S.p.A. Tel: +39 - 039 2471 |
Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
|
K????? ?.?.???µ???? & ??? ???. ???: +357 - 22 76 62 76 |
Sverige Roche AB Tel: +46 (0) 8 726 1200 |
|
Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
United Kingdom Roche Products Ltd. Tel: +44 (0) 1707 366000 |
A gyógyszerről részletes információ az Európai Gyógyszerügynökség internetes honlapján
(http://www.ema.europa.eu) található.
További információért olvassa el az alkalmazási előírást.
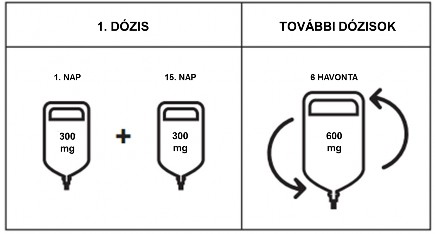
Adagolás
Kezdő dózis
A kezdő 600 mg dózist két külön intravénás infúzióban kell alkalmazni; elsőként egy 300 mg-os
infúziót kell alkalmazni, melyet 2 hét elteltével egy második 300 mg-os infúzió követ.
További dózisok
Ezt követően az Ocrevus további dózisait 6 havonta egyszeri, 600 mg-os intravénás infúzióban alkalmazzák (1. táblázat). A kezdő dózist követő 600 mg-os dózist hat hónappal a kezdő dózis első infúziója után kell beadni. Az egyes Ocrevus dózisok között minimálisan megtartandó időtartam
5 hónap.
ábra: Az Ocrevus dózisai és azok ütemezése
Az infúziós reakciók kezelése az infúzió előtt
Az Ocrevus-kezelést a súlyos reakciók, például súlyos infúziós reakciók, túlérzékenységi reakciók és/vagy anafilaxiás reakciók ellátásához szükséges, megfelelő orvosi támogatással rendelkező, tapasztalt egészségügyi szakember kell, hogy megkezdje és felügyelje.
Premedikáció az infúziós reakciók megelőzésére
A következő két premedikációt kell alkalmazni minden egyes infúzió előtt az infúziós reakció gyakoriságának és súlyosságának csökkentése érdekében:
-100 mg intravénás metilprednizolon (vagy annak megfelelő készítmény) körülbelül 30 perccel minden Ocrevus infúzió előtt;
-antihisztamin körülbelül 30-60 perccel minden Ocrevus infúzió előtt;
Emellett megfontolandó premedikációként lázcsillapító (pl. paracetamol) alkalmazása 30-60 perccel minden egyes Ocrevus infúzió előtt.
Az Ocrevus infúziók során előfordulhat hypotonia, mint az infúziós reakció egyik tünete. Ezért megfontolandó a vérnyomáscsökkentő kezelések szüneteltetése 12 órával az egyes Ocrevus infúziók előtt és az infúziók beadása során. Olyan betegeket, akiknek a kórtörténetében pangásos szívelégtelenség (New York Heart Association III és IV) szerepel, nem vizsgáltak.
A hígításra vonatkozó utasítások
Az Ocrevus-t egészségügyi szakembernek kell elkészíteni aszeptikus körülmények között. Az injekciós üveget nem szabad felrázni.
A gyógyszer kizárólag egyszeri alkalmazásra szolgál.
Az Ocrevus finom, áttetsző és/vagy fényvisszaverő részecskéket tartalmazhat, amelyek miatt opálosabb lehet. Ne használja az oldatot, ha elszíneződött vagy idegen részecskéket tartalmaz.
Az Ocrevus-t beadás előtt hígítani kell. Az Ocrevus intravénás oldat elkészítéséhez a készítményt egy izotóniás, 0,9%-os nátrium-klorid oldatot tartalmazó infúziós zsákban fel kell hígítani (300 mg/250 ml vagy 600 mg/500 ml), körülbelül 1,2 mg/ml végleges
hatóanyag-koncentrációra.
A hígított infúziós oldat beadásához 0,2 vagy 0,22 mikronos beépített szűrővel ellátott infúziós szereléket kell használni.
Az intravénás infúzió elindítása előtt az infúziós zsák tartalmának szobahőmérsékletűnek kell lennie annak érdekében, hogy elkerüljék az alacsony hőmérsékletű oldat beadása által okozott infúziós reakciót.
Az alkalmazás módja
Hígítás után az Ocrevus-t intravénás infúzióban alkalmazzák egy erre a célra szolgáló infúziós szereléken keresztül.
Az Ocrevus infúzió nem adható intravénás lökésterápiaként vagy bólusban.
|
Az Ocrevus beadandó mennyisége |
Az infúzió beadására vonatkozó utasítások | ||
|
Kezdő dózis (600 mg) 2 infúzióra osztva |
1. infúzió |
300 mg 250 ml oldatban |
30 ml/óra értékkel növelhető maximum 180 ml/óra értékig |
|
2. infúzió (2 héttel később) |
300 mg 250 ml oldatban | ||
|
További dózisok (600 mg) 6 havonta egyszer |
Egyszeri infúzió |
600 mg 500 ml oldatban |
40 ml/óra értékkel növelhető maximum 200 ml/óra értékig |
Az infúziót 30 ml/óra sebességgel kezdje el adagolni, 30 percen át
A sebesség 30 percenként
Minden infúziót körülbelül 2,5 óra alatt kell beadni
Az infúziót 40 ml/óra sebességgel kezdje el adagolni, 30 percen át
A sebesség 30 percenként
Minden infúziót körülbelül 3,5 óra alatt kell beadni
Az infúziós reakciók kezelése az infúzió közben és után
Az infúzió alatt és annak befejezése után még legalább egy órán át a betegeket megfigyelés alatt kell
tartani
Az infúzió adagolásának módosításai infúziós reakciók esetén
Ha bármelyik infúzió során infúziós reakciók alakulnak ki, lásd az alábbi módosításokat.
Életveszélyes infúziós reakciók
Ha az infúzió során életveszélyes vagy maradandó károsodást okozó infúziós reakció jelei, például akut túlérzékenység vagy akut respiratorikus distress szindróma figyelhetők meg, az infúziót azonnal le kell állítani, és a beteget a megfelelő kezelésben kell részesíteni. Az Ocrevus alkalmazását ezeknél a betegeknél véglegesen le kell állítani (lásd 4.3 pont).
Súlyos infúziós reakciók
Ha a beteg súlyos infúziós reakciót (mint például dyspnoe) vagy kipirulással, lázzal és torokfájással járó tünetegyüttest észlel, az infúziót azonnal le kell állítani, és a beteget tüneti kezelésben kell részesíteni. Az infúziót csak akkor szabad újraindítani, ha a tünetek teljesen megszűntek. Az újraindításkor az infúzió sebességét felére kell csökkenteni ahhoz a sebességhez képest, amelyet a reakció jelentkezésekor alkalmaztak. Az ezt követő új infúziók esetében nem szükséges az infúzió módosítása, kivéve, ha a beteg infúziós reakciót észlel.
Enyhe vagy közepesen súlyos infúziós reakciók
Ha a beteg enyhe vagy közepesen súlyos infúziós reakciót (pl. fejfájás) észlel, akkor az infúzió sebességét felére kell csökkenteni ahhoz a sebességhez képest, amelyet az esemény jelentkezésekor alkalmaztak. Ezt a csökkentett sebességet legalább 30 percen át fent kell tartani. Ha a beteg tolerálja, akkor ezután az infúzió sebessége újra megnövelhető a betegnél alkalmazott kezdeti infúzió sebességére. Az ezt követő új infúziók esetében nem szükséges az infúzió módosítása, kivéve, ha a beteg infúziós reakciót észlel.
Azon betegek esetében, akik a tüdőt érintő súlyos tüneteket, például hörgőgörcsöt vagy asztma exacerbációt észlelnek, az infúziót azonnal és véglegesen le kell állítani. Tüneti kezelés után a beteget megfigyelés alatt kell tartani a tűdőt érintő tünetek megszűnéséig, mert a klinikai tünetek kezdeti javulását ismételt romlás követheti.
A túlérzékenység és az infúziós reakció tünetei nehezen különböztethetőek meg. Ha az infúzió beadása közben túlérzékenységi reakció gyanúja merül fel, akkor az infúziót azonnal és véglegesen le kell állítani.
Az Ocrevus-szal kezelt betegeket az infúzió befejezése után legalább egy órát át megfigyelés alatt kell tartani az infúziós reakció tüneteinek észlelése céljából.
Az orvosoknak fel kell hívniuk a betegek figyelmét arra, hogy infúziós reakció az infúzió befejezése után 24 órán belül bármikor kialakulhat.
Felhasználhatósági időtartam
Bontatlan injekciós üveg
18 hónap
Hígított intravénás oldatos infúzió
Az oldat 2 °C-8 C közötti hőmérsékleten tárolva 24 órán át, ezt követően szobahőmérsékleten tartva 8 órán át őrzi meg kémiai és fizikai stabilitását.
Mikrobiológiai okokból az elkészített infúziót azonnal fel kell használni. Amennyiben nem használják fel azonnal, a felhasználó a felelős az elkészített oldat tárolási idejére és a felhasználást megelőző tárolási körülményekre vonatkozó előírások betartásáért; az oldat legfeljebb 24 órán át tárolható 2 C-8 C közötti hőmérsékleten, és ezt követően legfeljebb
8 órán át szobahőmérsékleten, kivéve, ha a hígítás ellenőrzött és validált aszeptikus körülmények között történt.
Amennyiben az intravénás infúzió nem fejezhető be ugyanazon a napon, akkor a megmaradt oldatot ki kell önteni.