Milyen típusú gyógyszer a Lucentis és milyen betegségek esetén alkalmazható? Milyen típusú gyógyszer a Lucentis
A Lucentis egy oldat, amit a szembe injekcióznak be. A Lucentis az úgynevezett érújdonképződést (neovaszkularizációt) gátló gyógyszerek csoportjába tartozik. A benne lévő hatóanyag a ranibizumab.
Milyen betegségek esetén alkalmazható a Lucentis
A Lucentis-t felnőtteknél alkalmazzák látásromlást okozó, különböző szembetegségek kezelésére.
Ezeket a betegségeket a retina (ideghártya, a szemfenék fényérzékeny rétege) következő okok miatti károsodása okozza:
-
Szivárgó, rendellenes erek növekedése. Ez a jelenség olyan betegségekben figyelhető meg, mint például az időskori makuladegeneráció (AMD). Szintén előfordul patológiás rövidlátás (miópia) (PM), angioid sávok, centrális szerózus korioretinopátia vagy gyulladásos CNV talaján kialakuló érhártya neovaszkularizáció (CNV) esetén is.
-
Makulaödéma (a retina centrális részének vizenyője). Ezt a vizenyőt okozhatja a cukorbetegség (a betegséget diabéteszes makulaödémának (DMÖ) nevezik) vagy az ideghártya retinális vénáinak elzáródása (a betegséget retinális véna elzáródásnak (RVO) nevezik).
Hogyan hat a Lucentis?
A Lucentis specifikusan felismeri és kötődik a szemben jelenlévő, emberi vaszkuláris endoteliális növekedési faktor A-nak (VEGF-A) nevezett fehérjéhez. Túl nagy mennyiségben a VEGF-A rendellenes erek növekedését és a szem vizenyőjét idézi elő, ami olyan betegségekben, mint például az AMD, PM, CNV, DMÖ vagy RVO, a látás romlásához vezethet. A VEGF-A-hoz kötődve a Lucentis gátolni képes annak hatását, és megelőzi ezt a kóros növekedést és vizenyőt.
Ezekben a betegségekben a Lucentis segít megőrizni, és sok esetben javítani az Ön látását.
Tudnivalók a Lucentis beadása előtt
Ön nem kaphat Lucentis-t
-
ha allergiás a ranibizumabra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
-
ha a szemében vagy a szeme környékén fertőzés van.
-
ha a szeme fáj vagy vörös (súlyos szemgyulladása van).
Figyelmeztetések és óvintézkedések
A Lucentis beadása előtt beszéljen kezelőorvosával.
-
A Lucentis-t a szembe adott injekcióként alkalmazzák. Esetenként a Lucentis-kezelést követően felléphet a szem belső részének gyulladása, szemfájdalom vagy szemvörösség (gyulladás), a szem hátsó részét bélelő egyik réteg leválása vagy szakadása (a retina leválása vagy szakadása és a retina pigmenthámjának leválása vagy szakadása) vagy a szemlencse elhomályosodása (szürkehályog). Fontos, hogy az ilyen fertőzéseket vagy ideghártya-leválást a lehető leghamarabb felismerjék és kezeljék. Kérjük, azonnal értesítse kezelőorvosát, ha a következő tünetek bármelyikét tapasztalja: szemfájdalom; fokozódó kellemetlen érzés a szemben; fokozódó szemvörösség; homályos vagy csökkent látás; növekvő számú, apró, mozgó homály megjelenése a látótérben vagy fokozott fényérzékenység.
-
Egyes betegeknél a szemnyomás közvetlenül az injekció beadása után egy rövid ideig megnövekedhet. Ezt nem biztos hogy észleli, ezért kezelőorvosa minden injekció után ellenőrzi a szemnyomását.
-
Mondja el kezelőorvosának, ha korábban szembetegsége vagy szemészeti kezelése volt, vagy ha valaha szélütése volt vagy a szélütés múló tüneteit észlelte (a végtagok vagy az arc gyengesége vagy bénulása, beszédzavar vagy a beszéd megértésének zavara). Ezt az információt figyelembe veszi majd, amikor arról dönt, hogy a Lucentis alkalmas-e az Ön kezelésére.
Kérjük, olvassa el a 4. pontot („Lehetséges mellékhatások”) a Lucentis-kezelés alatt lehetségesen jelentkező mellékhatásokkal kapcsolatos további részletekért.
Gyermekek és serdülők (18 éves életkor alatt)
A Lucentis alkalmazása gyermekekben és serdülőkben még nem megalapozott, így ezen korosztályban az alkalmazása nem javasolt.
Egyéb gyógyszerek és a Lucentis
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
-
Azoknak a nőknek, akik teherbe eshetnek, hatékony fogamzásgátlást kell alkalmazniuk a kezelés alatt és az utolsó Lucentis injekció után még legalább további 3 hónapig.
-
Nincs tapasztalat a Lucentis terhes nőknél történő alkalmazásával. A Lucentis-t a terhesség ideje alatt nem szabad alkalmazni, csak akkor, ha a lehetséges előnyei felülmúlják a meg nem született gyermekre gyakorolt lehetséges kockázatokat. Ha Ön terhes, ha úgy véli, hogy terhes lehet, vagy ha terhességet tervez, a Lucentis-kezelés előtt beszélje ezt meg kezelőorvosával.
-
A Lucentis-kezelés nem ajánlott szoptatás idején, mivel nem ismert, hogy a Lucentis kiválasztódik-e az anyatejbe. A Lucentis-kezelés megkezdése előtt kérjen tanácsot kezelőorvosától vagy gyógyszerészétől.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre A Lucentis-kezelés után átmenetileg homályos látást tapasztalhat. Amennyiben ez előfordul, a homályos látás megszűnéséig ne vezessen gépjárművet és ne használjon gépeket.
Hogyan kell beadni a Lucentis-t?
A Lucentis-t szemészorvosa egyetlen injekció formájában adja be a szemébe, helyi érzéstelenítés mellett. Az injekció szokásos adagja 0,05 ml (ami 0,5 mg hatóanyagot tartalmaz). Az ugyanabba a szembe befecskendezett két adag beadása között eltelt időtartam legalább négy hét kell legyen. Az injekciót mindig a szemészorvos adja be Önnek.
A fertőzés megelőzése érdekében az injekció előtt kezelőorvosa gondosan kimossa az Ön szemét. Kezelőorvosa helyi érzéstelenítőt is fog adni Önnek, hogy csökkentsen vagy megelőzzön minden, az injekció beadásával járó esetleges fájdalmat.
A kezelés havi egy Lucentis injekcióval kezdődik. Kezelőorvosa ellenőrizni fogja a szeme állapotát, és attól függően, hogy Ön hogyan reagál a kezelésre, dönt majd arról, hogy kell-e, és mikor kell további kezelést kapnia.
A betegtájékoztató végén a „A Lucentis elkészítése és beadása” cím alatt részletes alkalmazási utasítás található.
Idősek (65 éves vagy idősebb)
A Lucentis-t az adag módosítása nélkül kaphatják 65 éves és idősebb betegek is.
A Lucentis-kezelés abbahagyása előtt
Amennyiben felmerül Önben a Lucentis-kezelés abbahagyása, a soron következő kontrollvizsgálat alkalmával beszélje meg ezt kezelőorvosával. Kezelőorvosa tanácsai segíthetnek Önnek dönteni, mennyi ideig folytassák a Lucentis-kezelést.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát.
Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A Lucentis alkalmazásával járó mellékhatásokat vagy maga a gyógyszer vagy az injekciós eljárás okozza, és főként a szemet érintik.
A legsúlyosabb mellékhatások alább kerülnek leírásra:
Gyakori súlyos mellékhatások (10 ember közül legfeljebb 1-et érinthet): A szemfeneket borító réteg, a retina leválása vagy szakadása (ideghártya-leválás vagy szakadás), ami fényfelvillanások és úszkáló homályok látását okozza, és átmeneti látásvesztésig fokozódhat, vagy a szemlencsék elhomályosodása (szürkehályog).
Nem gyakori súlyos mellékhatások (100 ember közül legfeljebb 1-et érinthet): Vakság, a szemgolyónak a szem belső része gyulladásával járó fertőzése (endoftalmítisz).
Az esetlegesen jelentkező tünetek a szemében fellépő fájdalom vagy fokozott kellemetlen érzés, a szem kivörösödésének súlyosbodása, homályos vagy csökkent látás, a látóterében lévő kis részecskék növekvő száma vagy fokozott fényérzékenység. Kérjük, azonnal szóljon kezelőorvosának, ha ezek közül a mellékhatások közül bármelyik kialakul Önnél.
A leggyakrabban jelentett mellékhatások alább kerülnek leírásra:
Nagyon gyakori mellékhatások (10 ember közül több mint 1-et érinthet)
A látást érintő mellékhatások közé tartoznak: szemgyulladás, szemfenéki bevérzés (retinavérzés), látászavarok, szemfájdalom, apró részecskék vagy pontok a látótérben (üvegtesti úszkáló homályok), bevérzett szemfehérje, szem irritáció, idegentest érzés a szemben, fokozott könnytermelés, a szemhéjak gyulladása vagy fertőzése, száraz szem, a szem kivörösödése vagy viszketése és a szemnyomás emelkedése.
A nem a látást érintő mellékhatások közé tartoznak: torokfájás, orrdugulás, orrfolyás, fejfájás és ízületi fájdalom.
A Lucentis-kezelést követően esetlegesen előforduló egyéb mellékhatások alább kerülnek leírásra:
Gyakori mellékhatások
A látást érintő mellékhatások közé tartoznak: A látásélesség csökkenése, a szem egyes részeinek duzzanata (érhártya és kötőhártya), a szaruhártya (a szem elülső része) gyulladása, apró foltok a szem felszínén, homályos látás, az injekció beadási helyén kialakuló vérzés, vérzés a szemben, a szem váladékozása, ami viszketéssel, kivörösödéssel és duzzanattal jár (kötőhártya-gyulladás), fényérzékenység, kellemetlen érzés a szemben, a szemhéj duzzanata, a szemhéj fájdalma.
A nem a látást érintő gyakori mellékhatások közé tartoznak: húgyúti fertőzések, alacsony vörösvértestszám (olyan tünetekkel, mint például a fáradtság, légszomj, szédülés, sápadt bőr), szorongás, köhögés, hányinger, allergiás reakciók, mint bőrkiütés, csalánkiütés, viszketés és bőrvörösség.
Nem gyakori mellékhatások
A látást érintő mellékhatások közé tartoznak: Gyulladás és vérzés a szem elülső részében, tályog kialakulása a szemen, a szemfelület központi részének elváltozásai, az injekció beadási helyén kialakuló fájdalom vagy irritáció, szokatlan érzés a szemben, a szemhéj irritációja.
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
Hogyan kell a Lucentis-t tárolni?
-
A gyógyszer gyermekektől elzárva tartandó!
-
A dobozon és az injekciós üveg címkéjén feltüntetett lejárati idő (Felhasználható/EXP) után ne alkalmazza a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
-
Hűtőszekrényben (2°C – 8°C) tárolandó. Nem fagyasztható!
-
Az alkalmazás előtt a bontatlan injekciós üveg legfeljebb 24 órán keresztül szobahőmérsékleten (25°C) tartható.
-
A fénytől való védelem érdekében az injekciós üveget tartsa a dobozában.
-
Ne használja fel a gyógyszert, ha a csomagolás sérült!
A csomagolás tartalma és egyéb információk
Mit tartalmaz a Lucentis?
-
A készítmény hatóanyaga a ranibizumab. Mililiterenként 10 mg ranibizumabot tartalmaz. Injekciós üvegenként 2,3 mg ranibizumabot tartalmaz 0,23 ml oldatban.. Ez biztosítja azt a felhasználható mennyiséget, ami egyetlen 0,05 ml-es adag, és 0,5 mg ranibizumabot tartalmaz.
-
Egyéb összetevők: ?,?-trehalóz-dihidrát; hisztidin-hidroklorid-monohidrát; hisztidin; poliszorbát 20; injekcióhoz való víz.
Milyen a Lucentis külleme és mit tartalmaz a csomagolás?
A Lucentis egy oldatos injekció, injekciós üvegbe töltve (0,23 ml). Tiszta, színtelen - halványsárga vizes oldat.
Három különböző csomagolás típus kapható: Injekciós üveg + injekciós készlet
A csomagolás a következőket tartalmazza: egy ranibizumabot tartalmazó injekciós üveg klórbutil
gumidugóval; egy tompa, filteres tű (18G x 11”, 1,2 mm x 40 mm, 5 mikrométer) az injekciós üveg tartalmának felszívásához, egy tű az injekció beadásához (30G x 1”, 0,3 mm x 13 mm) és egy fecskendő (1 ml) az injekciós üveg tartalmának felszívásához és az intravitrealis injekció beadásához. Minden alkotóelem kizárólag egyszeri felhasználásra szolgál.
Csak injekciós üveget tartalmazó csomagolás
A csomagolás a következőket tartalmazza: egy ranibizumabot tartalmazó injekciós üveg klórbutil gumidugóval. Az injekciós üveg kizárólag egyszeri felhasználásra szolgál.
Injekciós üveg + filteres tű csomagolás
A csomagolás a következőket tartalmazza: egy ranibizumabot tartalmazó injekciós üveg klórbutil gumidugóval; egy tompa, filteres tű (18G x 11”, 1,2 mm x 40 mm, 5 mikrométer) az injekciós üveg tartalmának felszívásához. Minden alkotóelem kizárólag egyszeri felhasználásra szolgál.
A forgalomba hozatali engedély jogosultja
Novartis Europharm Limited Vista Building
Elm Park, Merrion Road Dublin 4
Írország
Gyártó
Novartis Pharma GmbH Roonstrasse 25
90429 Nürnberg Németország
A készítményhez kapcsolódó további kérdéseivel forduljon a forgalomba hozatali engedély jogosultjának helyi képviseletéhez:
België/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11
Lietuva
Novartis Pharma Services Inc. Tel: +370 5 269 16 50
????????
Novartis Pharma Services Inc. ???.: +359 2 489 98 28
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11
Česká republika
Novartis s.r.o.
Tel: +420 225 775 111
Magyarország
Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00
Danmark
Novartis Healthcare A/S Tlf: +45 39 16 84 00
Malta
Novartis Pharma Services Inc. Tel: +356 2122 2872
Deutschland
Novartis Pharma GmbH Tel: +49 911 273 0
Nederland
Novartis Pharma B.V. Tel: +31 26 37 82 111
Eesti
Novartis Pharma Services Inc. Tel: +372 66 30 810
Norge
Novartis Norge AS Tlf: +47 23 05 20 00
??????
Novartis (Hellas) A.E.B.E. ???: +30 210 281 17 12
Österreich
Novartis Pharma GmbH Tel: +43 1 86 6570
Espana
Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00
Polska
Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888
France
Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00
Portugal
Novartis Farma - Produtos Farmaceuticos, S.A. Tel: +351 21 000 8600
Hrvatska
Novartis Hrvatska d.o.o. Tel. +385 1 6274 220
România
Novartis Pharma Services Romania SRL Tel: +40 21 31299 01
Ireland
Novartis Ireland Limited Tel: +353 1 260 12 55
Slovenija
Novartis Pharma Services Inc. Tel: +386 1 300 75 50
Ísland
Vistor hf.
Sími: +354 535 7000
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439
Italia
Novartis Farma S.p.A. Tel: +39 02 96 54 1
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
??????
Novartis Pharma Services Inc. ???: +357 22 690 690
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
Latvija
Novartis Pharma Services Inc. Tel: +371 67 887 070
United Kingdom
Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370
A betegtájékoztató legutóbbi felülvizsgálatának dátuma:
Egyéb információforrások
A gyógyszerről részletes információ az Európai Gyógyszerügynökség internetes honlapján (http://www.ema.europa.eu) található.
Az alábbi információk kizárólag egészségügyi szakembereknek szólnak: Kérjük, olvassa még el a 3. „Hogyan kell beadni a Lucentis-t?” pontot is. A Lucentis elkészítése és beadása
Egyszerhasználatos injekciós üveg, kizárólag intravitrealis alkalmazásra.
A Lucentis-t kizárólag intravitrealis injekciók beadásában jártas szemész szakorvos adhatja be.
Nedves AMD-ben, CNV-ben és diabeteses macula oedema okozta látásromlás, vagy RVO következtében kialakuló macula oedema esetén a Lucentis javasolt adagja 0,5 mg, egyszeri, intravitrealis injekció formájában adva. Ez 0,05 ml-es injekciós térfogatnak felel meg. Az ugyanabba a szembe befecskendezett két adag közötti szünet legalább négy hét kell legyen.
A kezelést havi egy injekcióval kell kezdeni, és a maximális látásélesség eléréséig és/vagy addig kell folytatni, amíg már nincs a betegség aktivitására utaló jel, azaz a kezelés folytatása mellett nem változik a látásélesség vagy nincs változás a betegség okozta egyéb panaszok és tünetek tekintetében. A nedves AMD-ben, DMO-ban és RVO-ban szenvedő betegeknél kezdetben három vagy több, egymást követő, havonkénti injekcióra lehet szükség.
Ezután az ellenőrzési és a kezelési intervallumokat az orvos kell meghatározza, és a betegség látásélességgel mért és/vagy anatómiai paraméterek alapján meghatározott aktivitásán kell alapulnia.
Ha az orvos véleménye alapján a vizuális és az anatómiai paraméterek azt mutatják, hogy a betegnek nem származik előnye a további kezeléstől, a Lucentis alkalmazását abba kell hagyni.
A betegségaktivitás monitorozásának részét kell képezze a klinikai vizsgálat, a funkcionális vizsgálat vagy a képalkotó módszerek (pl. optikai koherencia tomográfia vagy fluoreszcens angiográfia).
Ha a betegeket a „kezelés és kiterjesztett adagolási rend” szerint kezelik, amikor a maximális látásélesség elérésre került, és/vagy nincs a betegség aktivitására utaló jel, akkor a kezelési intervallumokat fokozatosan meg lehet hosszabbítani, amíg a betegség aktivitására utaló jelek vagy a látásromlás vissza nem térnek. A nedves AMD esetén a terápiás intervallumot egyszerre két hétnél többel nem szabad meghosszabbítani, és DMO esetén egyszerre legfeljebb egy hónappal lehet meghosszabbítani. RVO esetén a terápiás intervallumokat fokozatosan hosszabbítani lehet, ugyanakkor nem áll rendelkezésre elegendő adat ahhoz, hogy következtetést lehessen levonni ezeknek az időszakoknak a hosszát illetően. Ha a betegség aktivitása visszatér, a kezelési intervallumot ennek megfelelően le kell rövidíteni.
A CNV miatti látásromlás kezelését a betegség aktivitása alapján betegenként egyénileg kell meghatározni. Egyes betegeknek csak egy injekcióra lehet szükségük az első 12 hónap alatt. Mások gyakoribb kezelést igényelhetnek, beleértve a havonkénti injekciót is. A patológiás rövidlátás (PM) következtében kialakuló CNV esetén sok betegnek lehet, hogy csak egy vagy két injekcióra van szüksége az első év folyamán.
A Lucentis és a lézer fotokoaguláció DMO-ban és BRVO következtében kialakuló macula oedemában Van némi tapasztalat a Lucentis lézer fotokoagulációval együtt történő alkalmazásával kapcsolatosan. Ha ugyanazon a napon alkalmazzák, akkor a Lucentis-t legalább 30 perccel a lézer fotokoaguláció után kell adni. A Lucentis adható olyan betegeknek, akik korábban lézer fotokoagulációban részesültek.
Lucentis és verteporfin fotodinámiás kezelés PM következtében kialakult CNV-ben
A Lucentis és a verteporfin egyidejű alkalmazásával nincs tapasztalat.
A beadás előtt ellenőrizni kell, hogy a Lucentis injekciós oldatában ne legyenek szabad szemmel látható részecskék, illetve elszíneződés.
Az injekciót aszeptikus körülmények között kell beadni, mely magában foglalja a sebészi kézfertőtlenítést, steril kesztyű viselését, steril kendő és steril szemhéjterpesztő (vagy annak megfelelő eszköz) alkalmazását, és a szükség esetén steril körülmények között elvégezhető paracentézis lehetőségét. Az intravitrealis beavatkozás elvégzése előtt részletes anamnézist kell felvenni a túlérzékenységi reakciókra vonatkozóan. Az injekció beadása előtt megfelelő érzéstelenítés szükséges, és a szem körüli bőr, a szemhéjak és a szem felszínének fertőtlenítésére a helyi gyakorlatnak megfelelően széles spektrumú lokális mikrobaellenes kezelést kell alkalmazni.
Injekciós üveg + injekciós készlet
Minden alkotóelem steril és kizárólag egyszeri felhasználásra szolgál. Azok az alkotóelemek, melyek csomagolása sérült vagy a megbontás jeleit mutatják, nem alkalmazhatóak. A sterilitás csak akkor biztosítható, ha az alkotóelemek csomagolása sértetlen marad. Az ismételt felhasználás fertőzéshez vagy egyéb betegséghez/sérüléshez vezethet.
Csak injekciós üveget tartalmazó csomagolás
Az injekciós üveg kizárólag egyszeri felhasználásra alkalmazható. Az injekció beadása után bármilyen fel nem használt gyógyszert meg kell semmisíteni. Azok az injekciós üvegek, amelyek sérültek vagy a megbontás jeleit mutatják, nem alkalmazhatóak. A sterilitás csak akkor biztosítható, ha a csomagolás sértetlen marad.
Az előkészítéshez valamint az intravitrealis injekció beadásához a következő, egyszer használatos segédeszközök szükségesek:
-
5 µm filteres tű (18G)
-
1 ml steril fecskendő (0,05 ml-es jelzéssel)
-
injekciós tű (30G x 1”).
A Lucentis csomagolása nem tartalmazza ezeket az eszközöket.
Injekciós üveg + filteres tű csomagolás
Minden alkotóelem steril és kizárólag egyszeri felhasználásra szolgál. Azok az alkotóelemek, melyek csomagolása sérült vagy a megbontás jeleit mutatja, nem alkalmazhatók. A sterilitás csak akkor biztosítható, ha az alkotóelemek csomagolása sértetlen marad. Az ismételt felhasználás fertőzéshez vagy egyéb betegséghez/sérüléshez vezethet.
Az előkészítéshez valamint az intravitrealis injekció beadásához a következő, egyszer használatos segédeszközök szükségesek:
-
5 µm filteres tű (18G x 11”, 1,2 mm x 40 mm, mellékelve)
-
1 ml steril fecskendő (0,05 ml-es jelzéssel, a Lucentis csomagolása nem tartalmazza)
-
injekciós tű (30G x 1”, a Lucentis csomagolása nem tartalmazza).
A Lucentis intravitrealis alkalmazásának előkészítéséhez kérjük, tartsa be az alábbi utasításokat:
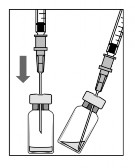
-
Az oldat felszívása előtt az injekciós üveg gumidugójának külső felszínét fertőtleníteni kell.
-
Egy 5 µm-es filteres tűt (18G x 11”, 1,2 mm x 40 mm, 5 µm) aszeptikus technikát alkalmazva illesszen össze egy 1 ml-es fecskendővel. Szúrja be a tompa filteres tűt az injekciós üveg gumidugójának közepén, amíg a tű hozzá nem ér az injekciós üveg aljához.
-
A függőlegesen tartott injekciós üvegből szívja fel az összes folyadékot. Ha kissé megdönti, könnyebben tudja felszívni az összes folyadékot.
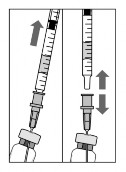
-
Az injekciós üveg kiürítése közben figyeljen oda, hogy a dugattyút kihúzza annyira, hogy a filteres tű teljesen kiürüljön.
-
Hagyja a tompa filteres tűt az injekciós üvegben, és vegye le a fecskendőt a tompa filteres tűről. Az injekciós üveg tartalmának kiszívása után a filteres tűt ki kell dobni, nem szabad az intravitrealis injekcióhoz felhasználni.
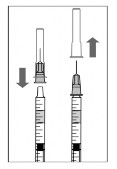
-
Aszeptikus módon és erősen csatlakoztasson egy injekciós tűt (30G x 1”, 0,3 mm x 13 mm) a fecskendőhöz.
-
Óvatosan vegye le az injekciós tű kupakját, úgy, hogy ne vegye le az injekciós tűt a fecskendőről.
Megjegyzés: A kupak eltávolítása közben szorosan fogja meg az injekciós tű csatlakozóját.
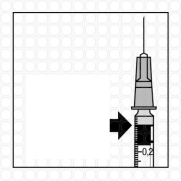
-
Gondosan távolítsa el a fecskendőből a levegőt a felesleges oldattal együtt, és az adagot állítsa a fecskendőn lévő 0,05 ml-es jelzéshez. A fecskendő kész az injekció beadására.