Betegtájékoztató: Információk a felhasználó számára
Fraxiparine 1900 NE/0,2 ml oldatos injekció
Fraxiparine 2850 NE/0,3 ml oldatos injekció
Fraxiparine 3800 NE/0,4 ml oldatos injekció
Fraxiparine 5700 NE/0,6 ml oldatos injekció
Fraxiparine 9500 NE/1,0 ml oldatos injekció
Fraxiparine Multi 47 500 NE/5 ml többadagos oldatos injekció
nadroparin‑kalcium
Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos információkat tartalmaz.
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
- További kérdéseivel forduljon kezelőorvosához vagy gyógyszerészéhez.
- Ezt a gyógyszert az orvos Önnek írta fel. Ne adja át a készítményt másnak, mert számára ártalmas lehet még abban az esetben is, ha a betegsége tünetei az Önéhez hasonlóak.
- Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd 4. pont.
A betegtájékoztató tartalma:
1. Milyen típusú gyógyszer a Fraxiparine és milyen betegségek esetén alkalmazható?
2. Tudnivalók a Fraxiparine alkalmazása előtt
3. Hogyan kell alkalmazni a Fraxiparine‑t?
4. Lehetséges mellékhatások
5. Hogyan kell a Fraxiparine‑t tárolni?
6. A csomagolás tartalma és egyéb információk
A Fraxiparine injekció hatóanyaga standard heparinból specifikus körülmények között készített kis molekulatömegű heparin kalcium sója.
Alkalmazása javasolt:
- vérrögképződéssel járó betegség megelőzésére sebészeti beavatkozások esetén;
- vérrögképződéssel járó betegség megelőzésére belgyógyászati betegek esetében;
- vérrögképződéssel járó betegségek: mélyvénás trombózis, tüdőembólia kezelésére;
- bizonyos akut szívkoszorúér‑megbetegedések kezelésére, kis dózisú acetilszalicilsav (szájon át történő) egyidejű adása mellett;
- művesekezelés alatt az alvadékképződés megelőzésére.
2. Tudnivalók a Fraxiparine alkalmazása előtt
Ne alkalmazza a Fraxiparine‑t:
· ha allergiás a nadroparin‑kalciumra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
· ha a korábbiakban előfordult Önnél vérlemezkeszám‑csökkenés nadroparin‑kezelés mellett.
· vérzés vagy a vérzés fokozott kockázata esetén, kivéve a heparin adásával össze nem függő alvadási zavart (DIC).
· vérzésre hajlamosító szervkárosodások (pl. aktív gyomorfekély) esetén.
· heveny (akut) vérzéssel járó agyi érkatasztrófákban (pl.: agyvérzéses állapotok).
· fertőzéses eredetű szívbelhártya‑gyulladás esetén.
· súlyos vesekárosodás esetén (kreatinin‑clearance < 30 ml/perc) ‑ tromboembóliás betegség, szívkoszorúér‑betegség kezelése esetén.
· 3 éves kor alatti gyermekeknél nem alkalmazhatóak a Fraxiparine Multi többadagos injekciók, mivel benzil‑alkoholt tartalmaznak.
· amennyiben a beteg nem megelőzés céljából, hanem tromboembóliás betegségek kezelésére kap Fraxiparine‑t, tervezett műtéti beavatkozás során helyi érzéstelenítés nem alkalmazható.
Figyelmeztetések, óvintézkedések
A Fraxiparine alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével:
· ha Önnél fokozott az ellenőrizhetetlen vérzés (hemorrágia) kockázata, beleértve az alábbi állapotokat:
- korábban előfordult súlyos gyomorfekély vagy egyéb vérzésre hajlamosító szervkárosodás,
- vérzési rendellenességek,
- közelmúltban végzett agy‑, gerinc‑ vagy szemműtét,
- magas vérnyomás.
· májelégtelenség esetén,
· közepesen súlyos vesekárosodás esetén (kreatinin‑clearance: 30‑50 ml/perc),
· a szem ér‑ és ideghártya eredetű betegségei esetén,
· ha magas a vér káliumszintje illetve erre hajlamosító betegség vagy káliumszintet emelő gyógyszerek szedése esetén.
Kórállapotok, amelyekre figyelnie kell
A Fraxiparine súlyosbíthat bizonyos fennálló kórképeket, vagy kiválthat súlyos mellékhatásokat. A Fraxiparine alkalmazása alatt Önnek figyelnie kell bizonyos tünetek megjelenésére, hogy csökkenthesse bármilyen káros hatás kockázatát (lásd a 4. pontban a „Kórállapotok, amelyekre figyelnie kell” részt).
Vérlemezkeszám‑csökkenés (trombocitopénia)
A heparin‑kezelés alatt ritkán a vérlemezkék számának kifejezett csökkenése fordulhat elő.
Előzetes kezelésekkel érzékennyé nem tett (nem szenzitizálódott) betegekben a vérlemezkeszám csökkenésére rendszerint a kezelést követő 5‑21 napon belül kerül sor. Érzékennyé vált (szenzitizálódott) betegnél ez néhány órán belül megtörténhet.
A nagyfokú vérlemezkeszám‑csökkenés azonban kapcsolatban állhat az artériás vagy vénás vérrögképződéssel (trombózissal), a vérrögképződés által okozott mélyvénás trombózissal vagy tüdőér‑elzáródással (tromboembóliával), de a testszerte jelentkező érpályán belüli véralvadási zavar (DIC ‑ disszeminált intravaszkuláris koagulopátia) fellépésével is.
Tájékoztassa azonnal kezelőorvosát, ha a vérlemezkeszám‑csökkenés okozta változó erősségű külső vagy belső vérzés tüneteit észleli (pl. piros vagy lila pontszerű bevérzés, véraláfutás a bőrön vagy szájnyálkahártyán, vérömleny a beadás helyén, véres vizelet, orrvérzés, gyomor‑bélrendszeri vérzés /pl. szurokszerű széklet/ stb).
A vérzést fokozhatják a vérzésre hajlamosító elváltozások, vesekárosodás fennállása, illetve bizonyos fajta gyógyszerek egyidejű szedése.
Ilyen esetekben a kezelőorvosnak a Fraxiparine alkalmazását azonnal fel kell függesztenie és másik véralvadásgátló kezelési módot kell mérlegelnie. A kezelőorvos ilyen esetben tájékoztatja Önt arról, hogy a jövőben Ön nem kaphat semmilyen heparin‑tartalmú gyógyszert.
Gerincközeli (epidurális vagy spinális) érzéstelenítés
Spinális vagy epidurális érzéstelenítésben részesülő betegeknél az alacsony molekulatömegű heparinok alkalmazása ritkán vérömlennyel (haematómával) szövődik, amely tartósan fennálló vagy állandósuló bénuláshoz vezethet.
A kockázat szintén növekszik trauma vagy ismételt epidurális-, vagy spinális érzéstelenítés során, vagy amikor gerincűri folyadékot távolítanak el (lumbálpunkció).
Idegrendszeri tünetek, mint hátfájás, érzéketlenség és gyengeség az alsó végtagokban; a belek és/vagy a húgyhólyag nem megfelelő működése esetén azonnal tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert!
Önnek rendszeres időközönként vérvételre van szüksége, mivel:
· ritka esetekben a Fraxiparine a vérlemezkék számának csökkenését okozhatja.
· a Fraxiparine növelheti a vér káliumszintjét. Önnél vérvizsgálatokat kell végezni, ha cukorbeteg, közepesen súlyos vesekárosodása van vagy a vér káliumszintjét befolyásoló egyéb gyógyszereket szed.
Nagyon ritka esetben súlyos bőrkárosodást (bőrelhalást) figyeltek meg, rendszerint az injekció beadásának helyén. Ezt vörös vagy fájdalmas, gyulladt bőrfoltok megjelenése előzi meg. Ilyen esetekben a kezelést azonnal fel kell függeszteni.
A Fraxiparine alkalmazásával kapcsolatban gyermekeknél és serdülőknél elégtelen klinikai tapasztalat áll rendelkezésre. Ezért a gyógyszer alkalmazása gyermekeknél és serdülőknek (18 éves kor alatt) nem ajánlott.
Időskorúak
Időseknél nincs szükség az adag módosítására, kivéve, ha fennáll a veseműködés károsodása. Idős betegeknél a kezelés megkezdése előtt ajánlott a veseműködés ellenőrzése.
Egyéb gyógyszerek és a Fraxiparine
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett/alkalmazott, valamint szedni/alkalmazni tervezett egyéb gyógyszereiről.
Közölje kezelőorvosával, ha acetilszalicilsavat vagy szalicilátot tartalmazó gyógyszert, egyéb nem‑szteroid gyulladáscsökkentő gyógyszert, illetve a vérlemezkék összetapadása ellen ható gyógyszert szed, mivel ezek növelhetik a vérzésveszélyt.
A Fraxiparine csak óvatosan alkalmazható szájon át szedhető véralvadásgátló szerekkel, keringésbe kerülő (glükokortikoid‑típusú) szteroidot tartalmazó gyógyszerkészítményekkel és dextránnal (volumenpótló szer).
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
A Fraxiparine alkalmazása terhesség alatt nem javasolt, kivéve, ha a várható terápiás előnyök meghaladják a lehetséges kockázatot.
A rendelkezésre álló kevés adat miatt a Fraxiparine alkalmazása szoptatás alatt nem javasolt.
A Fraxiparine előretöltött fecskendő (tűvédő kupakja) latexet tartalmaz
Ha latex allergiája van, tájékoztassa kezelőorvosát vagy gyógyszerészét a Fraxiparine alkalmazása előtt.
3. Hogyan kell alkalmazni a Fraxiparine‑t?
A gyógyszert mindig a kezelőorvos által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
A készítmény adagját az Ön állapotának, valamint testtömegének figyelembevételével a kezelőorvos fogja megállapítani. A kezelést a kezelőorvos által meghatározott ideig kell folytatni.
Alkalmazása gyermekeknél és serdülőknél
A Fraxiparine alkalmazása gyermekeknek és serdülőknek (18 éves kor alatt) nem ajánlott.
Fraxiparine alkalmazása
A Fraxiparine‑t bőr alá adott (szubkután) injekcióként kell alkalmazni.
A Fraxiparine‑t izomba (intramuszkulárisan) nem szabad beadni.
A beadás technikája: az injekciót a has elülső oldalsó területén redőt képezve a bőr alatti szövetbe kell beadni, felváltva jobb‑ és baloldalon (ez a szokásos beadási mód). A comb használható alternatív alkalmazási helyként. Az injekciós tűt, annak teljes hosszában a redőre merőlegesen kell beszúrni, a bőrredőt a beadás során végig tartani kell.
Esetenként vénába, vagy művesekezelés során artériába is kaphatja a Fraxiparine‑t.
Kérjük, lépésenként tanulmányozza az alábbi „Használati utasítás”‑t.
Használati utasítás
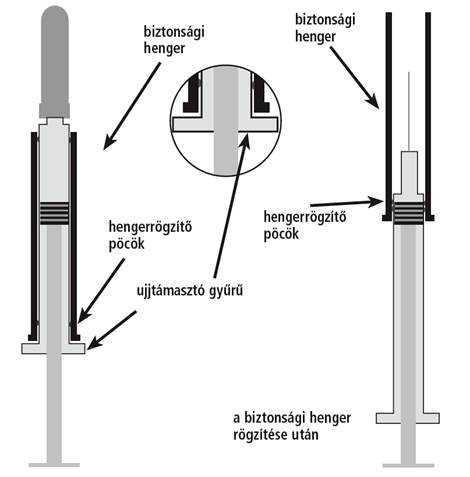
A biztonsági hengerrel ellátott Fraxiparine injekció részei
j Tűvédő kupak
k A fecskendő rúdja
l Ujjtámasztó gyűrű
m Biztonsági henger
A biztonsági henger az injekció BEADÁSA ELŐTT |
A biztonsági henger az injekció BEADÁSA UTÁN |
|
|
Amikor kiveszi a dobozából az előretöltött fecskendőt. |
Miután már elhelyezte a biztonsági hengert az injekciós tű köré (lásd a további ábrákat). |

Hogyan kell alkalmazni a Fraxiparine injekciót:
1. Mossa meg a kezét alaposan és szárítsa meg törölközővel.
2. Miután kiválasztotta az injekció beadási helyét, fertőtlenítse le azt egy alkoholos törlőkendővel.
3. Vegye le a tűvédő kupakot a tűről: csavaró mozdulat után egyenes vonalban húzza le a fecskendőről. A kupak eldobható.
4. Ha esetleg a kezelőorvos által előírt beadandó adag térfogata kisebb, mint a fecskendőben lévő oldat térfogata, az injekció beadása előtt a felesleget el kell távolítani:
· Tartsa a fecskendőt a tű hegyével egyenesen lefelé.
· Nyomja lefelé óvatosan a fecskendő rúdját, amíg a levegőbuborék alja az előírt mennyiséget jelző vonalig ér.
· A fecskendő ezután készen áll a beadásra.
Fontos:
· Ne érjen hozzá a tűhöz, illetve ne érintkezzen semmilyen felülettel a tű.
· Kis légbuborék jelenléte a fecskendőben normális jelenség. Ne próbálja eltávolítani a fecskendőből az injekció beadása előtt, mivel ezzel a gyógyszer egy részét is elveszítheti.
5. A kiválasztott beadási helyen fogja a bőrt redőbe a hüvelyk‑ és mutatóujjával, és végig tartsa így az injekció beadása alatt.
6. Fogja szorosan a fecskendőt az ujjtámasztó gyűrűnél fogva. Az injekciós tűt, annak teljes hosszában a redőre merőlegesen kell beszúrni.
7. A fecskendő rúdját teljesen benyomva adja be a fecskendő teljes tartalmát. Gyengéden húzza ki a tűt a bőrből. A beadás helyét tilos dörzsölni.
Az injekció beadása után a biztonsági hengert rá kell húzni a Fraxiparine injekció tűjére.
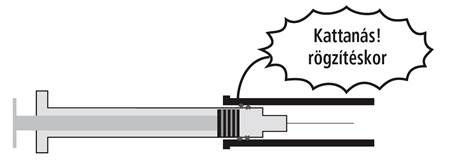
1. Az injekció beadása után egyik kezével fogja meg a fecskendő testét körülvevő biztonsági hengert, másik kezével pedig az ujjtámasztó gyűrűt. Húzza erősen az ujjtámasztó gyűrűt, majd miután a fecskendőt körülvevő biztonsági hengert kilazította, húzza erősen a tű irányába a biztonsági hengert, amíg az kattanással rögzül.
2. A biztonsági henger kilazításakor, majd annak rögzítésekor ellenállást fog tapasztalni.
Figyeljen a kattanó hangra, mert csak ekkor rögzül a biztonsági henger az injekciós tű körül.
3. A biztonsági henger teljesen körülveszi a használt tűt, így nem okozhat véletlenszerű tűszúrást.
Ha az előírtnál több Fraxiparine‑t alkalmazott
Keresse fel kezelőorvosát vagy gyógyszerészét, a fokozott vérzési kockázat lehetősége miatt.
Ha elfelejtette alkalmazni a Fraxiparine‑t
· Ne adjon be kétszeres adagot az elfelejtett adag helyett.
· Ha nem biztos benne mit kell tennie, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Kórállapotok, amelyekre figyelnie kell
Allergiás reakciók: Ezek nagyon ritkán fordulnak elő a Fraxiparine‑t alkalmazó betegeknél. Az allergiás reakciók jelei az alábbiak lehetnek:
· kiemelkedő és viszkető bőrkiütések (csalánkiütések),
· duzzanat, néha az arcon vagy a szájüregben (angioödéma), amely légzési nehézséget okozhat,
· hidegrázás, bőrpír, csalánkiütés, köhögés, tüsszögés, vizenyő (ödéma), ájulásérzés (anafilaktoid reakció).
A bőr elhalása az injekció beadásának helyén.
Változó erősségű külső vagy belső vérzés (úgymint: piros vagy lila pontszerű bevérzés, véraláfutás a bőrön és a szájnyálkahártyán, a beadás helyén jelentkező vérömleny, véres vizelet, orrvérzés, gyomor‑bélrendszeri vérzés (pl. szurokszerű széklet) esetén. A vérzést fokozhatják a vérzésre hajlamos elváltozások, veseelégtelenség illetve bizonyos fajta gyógyszerek egyidejű szedése (lásd 2. pontban „Egyéb gyógyszerek és a Fraxiparine”).
è Azonnal értesítse kezelőorvosát, ha a fent felsorolt tünetek bármelyikét észleli. Hagyja abba a Fraxiparine alkalmazását.
A mellékhatások lehetnek:
Nagyon gyakori (10 kezelt betegből több mint 1‑et érinthet):
· vérzések megjelenése különböző helyeken, többnyire azoknál a betegeknél, akiknél egyéb kockázati tényező is fennáll. (Látható vagy rejtetten jelentkező vérzéses szövődmények, különösen a bőrön, a nyálkahártyákon, sebekben, a tápcsatornában illetve a húgyutakban, amely vérzéses eredetű vérszegénységhez vezethet);
· az injekció beadásának helyén vérömleny képződése.
Gyakori (10 kezelt betegből legfeljebb 1 –et érinthet):
· egyes májenzim‑értékek átmeneti emelkedése;
· reakciók az injekció beadásának helyén.
Ritka (1000 kezelt betegből legfeljebb 1‑et érinthet):
· a vérlemezkeszám csökkenése illetve emelkedése;
· mészlerakódás az injekció beadásának helyén, különösen krónikus veseelégtelenségben szenvedő betegeknél;
· kiütés, csalánkiütés, bőrpír, viszketés;
Nagyon ritka (10 000 kezelt betegből legfeljebb 1‑et érinthet):
· allergiás reakciók a végtagok vizenyősségét (ödéma) és bőrreakciókat is beleértve;
· esetlegesen életveszélyes túlérzékenységi (anafilaktoid) reakció, amelynek tünetei hidegrázás, bőrpír, csalánkiütés, köhögés, tüsszögés, vizenyő (ödéma), ájulásérzés;
· bizonyos fehérvérsejtek (eozinofilek) számának átmeneti emelkedése (eozinofília);
· a vér kálium szintjének (átmeneti) emelkedése heparin kiváltotta átmeneti aldoszteronhiány (hipoaldoszteronizmus) következtében, különösen erre veszélyeztetett betegeknél;
· a hímvessző szexuális inger nélküli tartós megmerevedése. Sürgősen lépjen kapcsolatba kezelőorvosával, ha ez előfordul Önnél. Önnek orvosi ellátásra lehet szüksége a súlyos szövődmények elkerülése érdekében;
· bőrelhalás, általában az injekció beadásának helyén.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Fraxiparine‑t tárolni?
A gyógyszer gyermekektől elzárva tartandó.
Legfeljebb 30°C‑on tárolandó.
Fraxiparine Multi többadagos injekció: az injekciós üveg felbontás után szobahőmérsékleten (max. +25°C) 28 napig tárolható és használható fel.
A címkén vagy dobozon feltüntetett lejárati idő (Felh.:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Fraxiparine, ill. a Fraxiparine Multi injekció?
Fraxiparine injekciók
- A készítmény hatóanyaga:
1900 AXa NE nadroparin‑kalcium előretöltött fecskendőnként (0,2 ml vizes oldatban), ill.
2850 AXa NE nadroparin‑kalcium előretöltött fecskendőnként (0,3 ml vizes oldatban), ill.
3800 AXa NE nadroparin‑kalcium előretöltött fecskendőnként (0,4 ml vizes oldatban), ill.
5700 AXa NE nadroparin‑kalcium előretöltött fecskendőnként (0,6 ml vizes oldatban), ill.
7600 AXa NE nadroparin‑kalcium előretöltött fecskendőnként (0,8 ml vizes oldatban), ill.
9500 AXa NE nadroparin‑kalcium előretöltött fecskendőnként (1,0 ml vizes oldatban).
- Egyéb összetevők: kalcium‑hidroxid oldat (a kémhatás beállítására), hígított sósav (a kémhatás beállítására), injekcióhoz való víz.
Fraxiparine Multi többadagos injekció
- A készítmény hatóanyaga:
47 500 AXa NE nadroparin‑kalcium injekciós üvegenként (5,0 ml vizes oldatban).
- Egyéb összetevők: kalcium‑hidroxid oldat (a kémhatás beállítására), hígított sósav (a kémhatás beállítására), injekcióhoz való víz, 9 mg/ml benzil‑alkohol.
Minden kiszerelési egység 9500 NE/ml koncentrációjú.
Milyen a Fraxiparine külleme és mit tartalmaz a csomagolás?
Fraxiparine injekciók:
Tiszta vagy enyhén opálos, színtelen vagy halványsárga, vagy halvány sárgás-barna, vagy halvány barna steril oldat.
Fraxiparine Multi többadagos injekció:
Tiszta vagy enyhén opálos, színtelen, halványsárga, vagy halvány sárgás-barna, vagy halvány barna steril oldat.
Csomagolás:
10 db 0,2 ml‑es injekció (1900 NE) – biztonsági hengerrel ellátott, beosztás nélküli egyszer használatos előretöltött fecskendőben,
10 db vagy 50 db 0,3 ml‑es injekció (2850 NE) – biztonsági hengerrel ellátott, beosztás nélküli egyszer használatos előretöltött fecskendőben,
2 db, 10 db vagy 50 db 0,4 ml‑es injekció (3800 NE) – biztonsági hengerrel ellátott, beosztás nélküli egyszer használatos előretöltött fecskendőben,
10 db vagy 50 db 0,6 ml‑es injekció (5700 NE) – biztonsági hengerrel ellátott, beosztással rendelkező egyszer használatos előretöltött fecskendőben,
10 db 0,8 ml‑es injekció (7600 NE) – biztonsági hengerrel ellátott, beosztással rendelkező egyszer használatos előretöltött fecskendőben,
10 db 1,0 ml‑es injekció (9500 NE) – biztonsági hengerrel ellátott, beosztással rendelkező egyszer használatos előretöltött fecskendőben,
10 db 5,0 ml‑es többadagos injekció (47 500 NE) – klórbutil gumidugóval és lepattintható sárgászöld műanyag védőlappal ellátott, rollnizott alumínium kupakkal lezárt, színtelen injekciós üvegben.
A forgalomba hozatali engedély jogosultja és a gyártó
A forgalomba hozatali engedély jogosultja:
Aspen Pharma Trading Limited,
3016 Lake Drive, Citywest Business Campus, Dublin 24, Írország
Gyártó:
Aspen Notre Dame de Bondeville
1, rue de l’Abbaye, 76960 Notre Dame de Bondeville, Franciaország
vagy (a Fraxiparine Multi 47 500 NE/5 ml többadagos oldatos injekció 10× ‑ OGYI‑T‑6770/07) esetében:
Glaxo Operation UK Limited (Trading as Glaxo Wellcome Operations)
Harmire Road, Barnard Castle, Co Durham, DL 12 8DT, Nagy‑Britannia
Aspen Bad Odesloe GmbH
Industriestraβe 32-36, 23843 Bad Odesloe, Németország
OGYI‑T‑6770/01 Fraxiparine 1900 NE/0,2 ml oldatos injekció 10×
OGYI‑T‑6770/02 Fraxiparine 2850 NE/0,3 ml oldatos injekció 10×
OGYI‑T‑6770/09 Fraxiparine 2850 NE/0,3 ml oldatos injekció 50×
OGYI‑T‑6770/08 Fraxiparine 3800 NE/0,4 ml oldatos injekció 2×
OGYI‑T‑6770/03 Fraxiparine 3800 NE/0,4 ml oldatos injekció 10×
OGYI‑T‑6770/10 Fraxiparine 3800 NE/0,4 ml oldatos injekció 50×
OGYI‑T‑6770/04 Fraxiparine 5700 NE/0,6 ml oldatos injekció 10×
OGYI‑T‑6770/11 Fraxiparine 5700 NE/0,6 ml oldatos injekció 50×
OGYI‑T‑6770/05 Fraxiparine 7600 NE/0,8 ml oldatos injekció 10×
OGYI‑T‑6770/06 Fraxiparine 9500 NE/1,0 ml oldatos injekció 10×
OGYI‑T‑6770/07 Fraxiparine Multi 47 500 NE/5 ml többadagos oldatos injekció 10×
A betegtájékoztató legutóbbi felülvizsgálatának dátuma: 2016. július