Octanate 250 NE por és oldószer oldatos injekcióhoz
Octanate 500 NE por és oldószer oldatos injekcióhoz
Octanate 1000 NE por és oldószer oldatos injekcióhoz
Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót.
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
- További kérdéseivel forduljon orvosához vagy gyógyszerészéhez.
- Ezt a gyógyszert az orvos személyesen Önnek írta fel. A készítményt másoknak átadni nem szabad, mert számukra ártalmas lehet még abban az esetben is, ha tüneteik az Önéhez hasonlóak.
A betegtájékoztató tartalma:
1. Milyen típusú gyógyszer az Octanate injekció és milyen betegségek esetén alkalmazható?
2. Tudnivalók az Octanate injekció alkalmazása előtt
3. Hogyan kell alkalmazni az Octanate injekciót?
4. Lehetséges mellékhatások
5 Tárolás
6. További információk
A készítmény hatóanyaga: Humán koagulációs VIII. faktor, fagyasztással szárítva.
Porampulla:
Octanate 250 NE: 250 NE Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max. 5,5 mg
Octanate 500 NE: 500 NE Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max 11 mg
Octanate 1000 NE: 1000 NE Faktor VIII coagulationis humanus (Humán VIII. véralvadási faktor)
Össz-fehérje max 22 mg
Egyéb összetevők: nátrium-citrát, nátrium klorid, kalcium-klorid, glicin.
Oldószert tartalmazó injekciós üveg:
Injekcióhoz való víz
Az Octanate nem tartalmaz antimikrobiális vagy tartósító szereket.
Leírás: Injekció: fehér vagy halványsárga színű, liofilezett, steril por + oldószer (színtelen, tiszta steril injekcióhoz való víz)
Csomagolás:
Porampulla: liofilezett por, halobutil gumidugóval, rollnizott alumíniumkupakkal és lepattintható műanyag fedéllel lezárt színtelen injekciós üvegbe (I. típusú) töltve.
Oldószert tartalmazó injekciós üveg:
5 ml (Octanate 250 NE), 10 ml (Octanate 500 NE, Octanate 1000 NE) színtelen, tiszta steril injekcióhoz való víz, halobutil gumidugóval, rollnizott alumíniumkupakkal és lepattintható műanyag fedéllel lezárt színtelen injekciós üvegbe töltve.
1 db porampulla dobozban. A dobozhoz egy másik doboz csatlakozik, melyben 1 db injekciós üveg található a beadást segítő eszközökkel, melyek: 1 db egyszer használatos fecskendő, 1 db áttöltő készlet (Mix2VialTM), 1 db infúziós szerelék és alkoholos tamponok.
A két doboz egy kartondobozba van csomagolva.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A forgalomba hozatali engedély jogosultja:
Octapharma (IP) Limited, The Zenith Building, 26 Spring Gardens, Manchester M2 1AB
Egyesült Királyság
Gyártó:
Octapharma Pharmazeutika Produktionsges.m.b.H., Oberlaaerstr.235, 1100 Bécs, Ausztria
vagy
Octapharma S.A.S., 70 - 72 Rue du Marechal Foch, 67381 Lingolsheim, Franciaország
vagy
Octapharma AB, SE-112 75 Stockholm, Svédország
1. MILYEN TÍPUSÚ GYÓGYSZER AZ OCTANATE INJEKCIÓ ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
Az Octanate a humán VIII. koagulációs faktort tartalmazza por alakban, valamint injekcióhoz való vizet. A mellékelt oldószerben való feloldás után az Octanate intravénásan alkalmazandó.
Az Octanate 250 NE por és oldószer oldatos injekcióhoz 250 NE humán koagulációs VIII-as faktort tartalmaz porampullánként, mely max. 5,5 mg fehérjét jelent. A mellékelt 5 ml injekcióhoz való vízzel (Ph.Eur.) kell feloldani, így az injekció körülbelül 50 NE/ml humán koagulációs VIII-as faktort tartalmaz.
Az Octanate 500 NE por és oldószer oldatos injekcióhoz 500 NE humán koagulációs VIII-as faktort tartalmaz porampullánként, mely max. 11 mg fehérjét jelent. A mellékelt 10 ml injekcióhoz való vízzel (Ph.Eur.) kell feloldani, így az injekció körülbelül 50 NE/ml humán koagulációs VIII-as faktort tartalmaz.
Az Octanate 1000 NE por és oldószer oldatos injekcióhoz 1000 NE humán koagulációs VIII-as faktort tartalmaz porampullánként, mely max. 22 mg fehérjét jelent. A mellékelt 10 ml injekcióhoz való vízzel (Ph.Eur.) kell feloldani, így az injekció körülbelül 100 NE/ml humán koagulációs VIII-as faktort tartalmaz.
Az Octanate-t a vérzés kezelésére és megelőzésére alkalmazzák az alábbi betegségekben szenvedő betegek esetében:
· hemofília A (örökletes, vagyis születéstől fennálló VIII. faktor hiány),
· szerzett VIII. faktor hiány,
· a VIII. faktor ellen termelődő antitestek (inhibitorok) által kiváltott hemofília.
2. TUDNIVALÓK AZ OCTANATE INJEKCIÓ ALKALMAZÁSA ELŐTT
Nem alkalmazható az Octanate:
· ha túlérzékeny (allergiás) a termék bármely összetevőjére.
Az Octanate fokozott elővigyázatossággal alkalmazható:
· Mint minden vénába adott (intravénásan alkalmazott) fehérjeterméknél, előfordulhatnak allergiás jellegű túlérzékenységi (hiperszenzitivitási) reakciók. A túlérzékenységi reakciók korai jelei többek között az alábbiak lehetnek: bőrkiütés, általános csalánkiütés, szorító mellkasi érzés, zihálás, alacsony vérnyomás, súlyos allergiás reakció (anafilaxia). Ezeknek a tüneteknek a fellépése esetén azonnal szüntesse be a szer adagolását (befecskendezését) és kérje orvosa tanácsát. Keringés összeomlás (sokk) fellépésekor az aktuális standard orvosi sokk ellenes terápia alkalmazandó.
· Az emberi plazmából vagy vérből készített orvosi készítmények alkalmazása esetén a fertőző ágensek átviteléből származó fertőző betegségek kockázata nem zárható ki teljes mértékben. Ez érvényes a még ismeretlen jellegű patogén ágensekre is. Mindazonáltal a fertőző ágensek átvitelének kockázata csökkenthető az álabbiak szerint:
· A fertőző ágensek közvetítésének kockázatát azonban csökkenti
o A véradók (donorok) orvosi vizsgálattal történő kiválasztása és a levett minták három fő patogén vírusra, HIV-re, HCV-re és HBV-re történő szűrése,
o a plazmakészletek HBsAg-re, anti-HCV és anti-HIV 1/2 ellenanyagra és HCV genomra való szűrése,
o a gyártási folyamatban alkalmazott vírus eltávolító / inaktiváló eljárások alkalmazása, melyeket vírusmodellekkel validálták, és amelyek HIV, HCV, HAV és HBV ellen hatékonynak minősülnek. A víruscsökkentés lépéseiként az OCTANATE gyártási folyamatában szerepel a TNBP/Tween 80-nal folytatott S/D kezelés és egy hőkezelés a végleges tartályban.
o A vírus inaktiváló / eltávolító eljárás csak korlátozott hatással van az olyan burokkal nem bíró vírusok esetében, mint amilyen a parvovírus B19. A parvovírus B19 szero-negatív terhesekben vagy immunrendszeri károsodásban szenvedő betegekben súlyos reakciókat válthat ki.
· Ajánlott a plazmából nyert VIII-as faktor koncentrátumot kapó betegek megfelelő (hepatitis A és B) vakcinációja.
· Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok – különösen akkor, ha nagy mennyiségben vannak jelen – megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem állítható el Önnél, illetve gyermekénél az Octanate -tal, azonnal tájékoztassa erről kezelőorvosát.
· A betegek érdekében ajánlott minden alkalommal, amikor Octanate-ot kapnak, fel kell jegyezni a termék nevét és gyártási számát.
Terhesség és szoptatás
Az Octanate-tal nem végeztek reprodukciós és laktációs állatkísérleteket. A Octanate terhesség alatti biztonságos alkalmazására vonatkozóan nem állnak rendelkezésre adatok. Éppen ezért az Octanate-ot terhes vagy szoptató nőknek csak különösen indokolt esetben szabad beadni.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
A gépjárművezetéséhez és a gépek kezeléséhez szükséges képességekre gyakorolt hatást nem figyeltek meg.
Egyéb gyógyszerek alkalmazása (gyógyszerkölcsönhatás):
A humán koagulációs VIII-as faktor termékek más gyógyszerkészítményekkel való interakciója nem ismert. Az Octanate azonban nem adható semmilyen más gyógyszerrel együtt egy infúzióban.
3. HOGYAN KELL ALKALMAZNI AZ OCTANATE INJEKCIÓT?
A kezelést vérzékeny ( hemofíliás) betegek kezelésében jártas orvos felügyelete alatt kell megkezdeni. Az Octanate adagolása (adagok nagysága és a faktor pótló kezelés hossza) a VIII. faktor hiány súlyosságától, a vérzés helyétől és fokától és a beteg egészségi állapotától függ.
Kérje orvosa tanácsát, ha nem biztos abban, milyen mértékben kell a VIII. faktor aktivitást növelni, illetve, hogy hogyan kell kiszámítani ebből az adagolást.
Adagolás számítása
Az alkalmazott VIII. faktor egységszámot a WHO jelenlegi, a VIII. faktort tartalmazó termékekre vonatkozó szabványához kötődő nemzetközi egységben (NE) adják meg. A plazma VIII. faktor aktivitást százalékban (a normál emberi plazmához viszonyítva), vagy nemzetközi egységben (a plazma VIII. faktorra vonatkozó nemzetközi szabványhoz viszonyítva) fejezik ki.
Egy nemzetközi egységnyi (NE) VIII-as faktoraktivitás a normál emberi plazma 1 ml-ében lévő VIII-as faktor mennyiségének felel meg. A dózis kiszámítása azon az empirikus megfigyelésen alapul, miszerint 1 NE VIII-as faktor/ttkg a plazma VIII-as faktor aktivitását 1,5–2%-kal emeli. A szükséges dózis kiszámításához határozza meg vérplazmájában a VIII. faktor aktivitást, valamint, hogy mennyivel kell ezt a szintet növelni.
A szükséges adag (NE) a következő képlettel lehet meghatározni:
Szükséges adag (NE) = testtömeg (kg) x a kívánt VIII-as faktoraktivitás-emelkedés (%) x 0,5
A szükséges mennyiséget és a kezelés gyakoriságát mindig az egyedi esetben elért klinikai hatékonyságra való tekintettel kell meghatározni.
Az alábbi vérzéses epizódok esetén a megfelelő időtartam során a VIII-as faktoraktivitás szintje nem süllyedhet a megadott értékek alá (a normál érték százalékában). A következő táblázat útmutatóként használható vérzéses epizódok és sebészeti beavatkozások során:

Egyes esetekben, elsősorban a kezdő adagra vonatkozóan, a számítottnál nagyobb mennyiségre lehet szükség.
A betegek eltérően reagálhatnak a VIII-as faktorra, eltérő in vivo hasznosulási szintet érhetnek el és különbség lehet a plazma-féléletidőben is.
A szubsztitúciós kezelés véralvadási vizsgálatokkal történő (a plazma VIII-as faktoraktivitásának) gondos nyomonkövetése – elsősorban a nagyobb sebészeti beavatkozások után – elengedhetetlen.
Vérzés megelőzése: A súlyos haemophilia-A-ban szenvedő betegeknél a vérzések hosszú távú megelőzésére 20–40 NE VIII-as faktor/ttkg adagot kell alkalmazni 2–3 napos intervallumokban. Egyes esetekben, főleg fiatal betegeknél, rövidebb intervallumokra vagy nagyobb adagokra lehet szükség.
A 6 évesnél fiatalabb gyermekek esetében nem áll rendelkezésre elegendő adat az Octanate -kezelés javallatára.
Inhibitorok: A humán VIII-as koagulációs faktorral kezelt betegek esetében figyelemmel kell kísérni a gátló (inhibitor) antitestek termelődését. Ha a várt VIII. faktor szintet nem sikerül elérni, illetve ha a vérzés nem vonható kontroll alá a megfelelő adaggal, meg kell vizsgálni, nincs-e jelen a beteg szervezetében VIII. faktort gátló inhibitor. Ha az inhibitor szintje alacsonyabb, mint 10 Bethesda Egység (Bethesda Unit, BU)/ml, további VIII. humán koagulációs faktor adagolásával az inhibitor semlegesíthető. 10 BU feletti inhibitor titer esetén meg kell fontolni (aktivált) protrombin komplex koncentrátum (prothrombin complex concentrate, PCC) vagy rekombináns aktivált VII. faktor (rFVIIa) készítmények alkalmazását. Ezeket a kezeléseket hemofíliás betegek kezelésében jártas orvos irányítása alatt kell végezni.
Otthoni kezelésre vonatkozó utasítások
· Kérjük, gondosan olvassa el az utasításokat, és pontosan kövesse azokat!
· A címkén feltüntetett lejárati idő után ne alkalmazza a Octanate‑t.
· Az alább részletezett eljárás során a sterilitást mindvégig fenn kell tartani!
· A fecskendőben lévő oldatnak átlátszónak vagy gyöngyházfénnyel enyhén csillogónak kell lennie. Ne fecskendezze be az oldatot ha zavaros vagy csapadék látható benne.
· A mikrobák általi szennyeződés elkerülése érdekében azonnal használja fel az elkészített oldatot.
· Kizárólag a mellékelt injekciós készletet alkalmazza. Más injekciós/infúziós eszközök alkalmazása további kockázatokhoz és a kezelés sikertelenségéhez vezethet.
Utasítások az oldat elkészítéséhez:
1. Ne alkalmazza a készítményt közvetlenül azután, hogy kivette a hűtőszekrényből. Hagyja, hogy a zárt üvegekben lévő oldószer és por szobahőmérsékletűre melegedjenek.
2. Távolítsa el a port és az oldószert tartalmazó üvegek lepattintható kupakját, majd az egyik mellékelt alkoholos törlővel tisztítsa meg a gumidugókat.
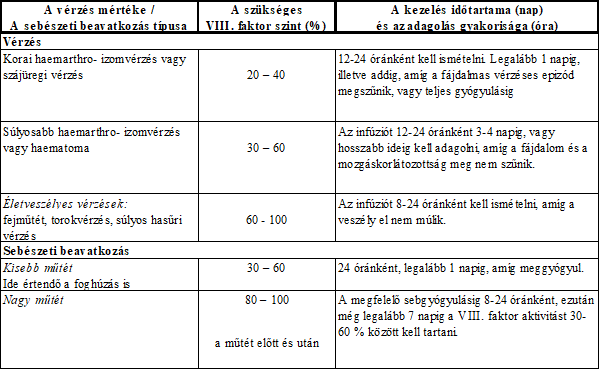
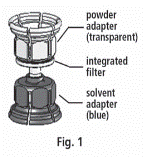
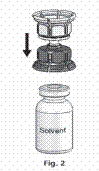
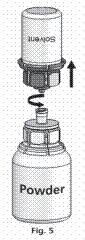
3. A Mix2vialTM az 1. ábrán látható. Helyezze az oldószert tartalmazó üveget sík felületre, és tartsa stabilan. Fogja a Mix2vialTM-t, és fordítsa tetejével lefelé. A Mix2vialTM kék részét helyezze az oldószeres üveg tetejére, majd határozottan nyomja le, amíg nem kattan (2. és 3. ábra).
|
|
|
|
|
|
|
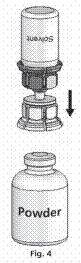
4. Helyezze a port tartalmazó üveget sík felületre, és tartsa stabilan. Fogja a Mix2VialTM-lal összekapcsolt oldószeres üveget, és fordítsa tetejével lefelé. Az átlátszó részét helyezze a port tartalmazó üveg tetejére, majd határozottan nyomja le, amíg nem kattan (4. ábra). Az oldószer magától a port tartalmazó üvegbe áramlik. |
|
||||||||
|
5. Miközben a két üveg össze van kapcsolva, óvatosan forgassa addig a port tartalmazó üveget, amíg a készítmény fel nem oldódik. Az oldódás szobahőmérsékleten kevesebb mint 10 perc alatt végbemegy. Enyhe habzás előfordulhat az oldat elkészítése során. Csavarozza szét két részre a Mix2VialTM-t (5. ábra). A habzás el fog tűnni. Dobja ki az üres oldószeres üveget és a Mix2VialTM hozzá csatlakozó kék részét. |
|
|
||||||
A biztonság kedvéért a pulzusát a befecskendezés előtt és annak folyamán mérni kell. Ha a pulzus észrevehetően emelkedik, akkor a befecskendezés sebességét le kell lassítani, vagy a beadást rövid ideig meg kell szakítani.
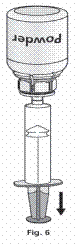
1. Csatlakoztassa a fecskendőt a Mix2VialTM átlátszó részéhez. Fordítsa az injekciós üveget tetejével lefelé, és szívjon oldatot a fecskendőbe (6. ábra).
A fecskendőben lévő oldatnak átlátszónak vagy gyöngyházfénnyel enyhén csillogónak kell lennie. Ha az oldat átkerült a fecskendőbe, akkor tartsa stabilan a fecskendő dugattyúját (úgy, hogy az lefelé nézzen), majd távolítsa el a fecskendőt a Mix2VialTM-ből (7. ábra).
Dobja ki a Mix2VialTM-t és az üres üveget.
|
|
|
|
2. Az egyik mellékelt alkoholos törlő segítségével tisztítsa meg a megszúrandó bőrfelületet.
3. Csatlakoztassa a mellékelt injekciós tűt a fecskendőhöz.
4.
Szúrja az injekciós tűt a
kiválasztott vénába. Amennyiben leszorítást alkalmazott a véna jobb
észlelhetősége céljából, akkor ezt a leszorítást a Octanate beadása előtt fel
kell engedni.
A fibrinalvadékok képződésének veszélye miatt nem szabad hagyni, hogy a vér
visszafolyjon a fecskendőbe,
5. Lassan fecskendezze be a vénába, nem gyorsabban mint 2-3 ml/perc.
Ha Ön egynél több injekciós üvegnyi Octanate port alkalmaz, akkor használhatja ugyanezt az injekciós tűt és fecskendőt. A Mix2VialTM csak egyszer használatos.
Csak engedélyezett injekciós készletet használjon. Bizonyos injekciós eszközök felső felületükön adszorbeálják (megkötik) a humán VIII. koagulációs faktort, mely a kezelés eredménytelenségét okozhatja.
Bármilyen fel nem használt oldatot, vagy hulladék anyagot a helyi hatóságok előírásaival összhangban kell megsemmisíteni.
Ha az előírtnál több Octanate injekciót kapott:
Nem jegyeztek a humán VIII. koagulációs faktor túladagolásával kapcsolatos tüneteket.
Ha elfelejtették alkalmazni az Octanate injekciót:
Tájékoztassa kezelőorvosát.
4. LEHETSÉGES MELLÉKHATÁSOK
Mint minden gyógyszernek, az Octanate -nak is lehetnek mellékhatásai.
Ritkán megfigyeltek túlérzékenységet vagy allergiás reakciókat. Ide tartozik az infúziós területen égető vagy szúró érzés, hőmérséklet-csökkenés, bőrpír, általános csalánkiütés, fejfájás, bőrkiütés, vérnyomás-csökkenés, letargia, émelygés, nyugtalanság, mellkasi nyomás, bizsergés, hányás, légszomj, ami egyes esetekben súlyos allergiás reakcióvá (anafilaxiává) fejlődhet (ideértve a sokkot is).
Ritka esetekben lázat is megfigyeltek.
A VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél nem gyakran (100 beteg közül kevesebb mint 1 esetben) inhibitor ellenanyagok (gátló hatású antitestek) jelenhetnek meg (lásd 2. pont). Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
A vírusbiztonságosságra vonatkozó információt lásd a 2. pontban.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül is a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. TÁROLÁS
2°C és 25°°C között, fénytől védve tárolandó.
Nem fagyasztható.
A feloldott készítményt azonnal be kell adni!
Ha a hűtőben rendelkezésre álló hely korlátozott, csak a koncentrátumot tartsa a hűtőben, az eszközcsomag és az injekciós víz szobahőmérsékleten is tárolható.
6. TOVÁBBI INFORMÁCIÓ
A jelen gyógyszerkészítménnyel kapcsolatos minden további kérdéssel kérjük, forduljon a forgalomba hozatali engedély jogosultjának helyi képviselőjéhez.
OGYI-T-6840/01 (Octanate 1000 NE)
OGYI-T-6840/02 (Octanate 250 NE)
OGYI-T-6840/03 (Octanate 500 NE)
A betegtájékoztató engedélyezésének dátuma: 2018. január