Betegtájékoztató: Információk a felhasználó számára
Kabiven emulziós infúzió
Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos információkat tartalmaz.
· Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
· További kérdéseivel forduljon kezelőorvosához, gyógyszerészéhez vagy a gondozását végző egészségügyi szakemberhez.
· Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert.
Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd 4. pont
A betegtájékoztató tartalma:
1. Milyen típusú gyógyszer a Kabiven és milyen betegségek esetén alkalmazható?
2. Tudnivalók a Kabiven alkalmazása előtt
3. Hogyan kell alkalmazni a Kabivent?
4. Lehetséges mellékhatások
5. Hogyan kell a Kabivent tárolni?
6. A csomagolás tartalma és egyéb információk
1. Milyen típusú gyógyszer a Kabiven és milyen betegségek esetén alkalmazható?
A Kabiven egy három rekeszes, külső csomagolással ellátott zsákban kerül forgalomba. A Kabiven az alábbi gyógyszereket tartalmazza: aminosavak, zsír, glükóz és elektrolit oldatok. Energiával (cukorral, zsírral) és aminosavakkal (fehérjékkel) látja el szervezetét, amikor nem tud a szokásos módon táplálkozni.
A Kabiven a kiegyensúlyozott intravénás táplálás részét képezi, sókkal, nyomelemekkel, vitaminokkal együtt, amelyek a teljes táplálkozási szükségletet biztosítják.
A gyógyszer teljes neve Kabiven emulziós infúzió. A betegtájékoztatóban a továbbiakban Kabivenként szerepel.
2. Tudnivalók a Kabiven alkalmazása előtt
Ne alkalmazza a Kabivent
· ha Ön allergiás a hatóanyagokra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére,
· ha Ön allergiás a tojást, szóját vagy földimogyorót tartalmazó termékekre,
· ha az Ön vérének túl magas a zsírtartalma (például koleszterin),
· ha az Ön májfunkciója jelentősen csökkent,
· akut (nagy vérveszteség vagy allergiás reakció miatt kialakult) sokk esetén,
· ha Önnek egy hemofagocitózis szindróma nevű állapottal kísért vérzészavara van, vagy véralvadási rendellenessége van,
· ha Ön aminosav vagy fehérje anyagcsere zavarával járó betegségben szenved,
· ha Önnek súlyos veseelégtelensége van,
· olyan magas vércukorszinttel járó állapot (hiperglikémia) esetén, amelynek kezeléséhez óránként több mint 6 E inzulin adására van szükség,
· ha az Ön vérében magas az elektrolitok (sók) szintje,
· ha Önnek metabolikus acidózisa van (a testfolyadékok és a szövetek savtartalma túl magas),
· ha Önnek túl sok folyadék van a szervezetében – hiperhidráció,
· tüdővizenyő (akut tüdőödéma) esetén,
· kómában,
· szívproblémák esetén,
· alacsony elektrolitszinttel járó kiszáradás esetén,
· súlyos vérmérgezés (szepszis - olyan állapot, melynek során szervezete súlyos fertőzéssel küzd) esetén.
Figyelmeztetések és óvintézkedések
A Kabiven alkalmazása előtt beszéljen kezelőorvosával
· ha májműködése csökkent,
· ha nem karbantartott cukorbetegségben szenved,
· ha zsíranyagcsere-zavarban szenved,
· ha károsodott a vesefunkciója,
· ha hasnyálmirigy problémája van,
· ha pajzsmirigyproblémája van – pajzsmirigy-alulműködés,
· ha szepszise van (olyan állapot, melynek során szervezete súlyos fertőzéssel küzd),
· elektrolit háztartás zavar esetén,
· ha szervezete sejtjeiben kevés az oxigén,
· ha szérum ozmolaritása megnövekedett.
Ha az infúzió beadása során láz, kiütés, hidegrázás vagy nehézlégzés jelentkezik, akkor azonnal értesítse az egészségügyi szakembert. Ezeket a tüneteket allergiás reakció vagy a készítmény túladagolása okozhatja (lásd 4. pont).
Ez a gyógyszer befolyásolhatja egyéb vizsgálatok eredeményeit. Fontos, hogy tájékoztasson minden vizsgálatot kérő orvost arról, hogy a Kabivent alkalmazzák Önnél.
Lehetséges, hogy kezelőorvosa rendszeres vérvizsgálatokat kíván végezni annak ellenőrzése érdekében, hogy szervezete jól hasznosítja-e a Kabivent.
Gyermekek
A Kabiven újszülötteknek és 2 év alatti gyermekeknek nem adható.
Egyéb gyógyszerek és a Kabiven
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Tájékoztassa kezelőorvosát, ha
· heparin nevű gyógyszert kap, amely megakadályozza a vérrögök kialakulását, és segíti azok feloldódását
· K1-vitaminként warfarint szed, amely szójabab olajat tartalmaz, és befolyásolhatja a vér alvadási képességét
· inzulint kap a cukorbetegség kezelésére
Terhesség és szoptatás
A Kabiven terhesség és szoptatás alatt történő biztonságos alkalmazhatóságát nem vizsgálták. Ha terhesség vagy szoptatás alatt szükségessé válik a közvetlenül vénán keresztül (parenterálisan) történő táplálás, akkor kezelőorvosa kizárólag alapos mérlegelés után fogja Önnek beadni a Kabivent.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Nem értelmezhető, mivel ezt a gyógyszert kizárólag kórházi körülmények között alkalmazzák.
3. Hogyan kell alkalmazni a Kabivent?
A gyógyszert centrális vénába beadott infúzió formájában fogja megkapni.
A Kabiven adagját és a felhasznált zsák méretét a testtömeg és a szervezet zsír- és cukorfelhasználási képességének megfelelően kell meghatározni. A Kabiven infúziót lassan, 12–24 óra alatt kell beadni. Kezelőorvosa fogja meghatározni az Ön vagy gyermeke számára megfelelő adagot.
Lehetséges, hogy a kezelés során monitorozni fogják.
Alkalmazása gyermekeknél
A Kabiven nem alkalmazható újszülöttek és két év alatti gyermekek kezelésére.
Ha az előírtnál több Kabivent alkalmaztak Önnél
Nagyon valószínűtlen, hogy az előírtnál több infúziót kap, mivel kezelőorvosa vagy a nővér monitorozni fogja Önt a kezelés ideje alatt.
A túladagolás tünetei a hányinger, hányás, hidegrázás és folyadékvisszatartás lehetnek. Hiperglikémiáról (túl magas vércukorszintről) és elektrolit egyensúlyzavarok előfordulásáról is beszámoltak. Túladagolás esetén fennáll a túl sok zsír bevitelének veszélye. Ezt „zsír-túltelítődési szindrómának” hívják. További információt a Lehetséges mellékhatások című, 4. pontban talál. Ha a fenti tünetek közül bármelyiket tapasztalja, vagy úgy gondolja, hogy túl sok Kabivent kapott, akkor haladéktalanul tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert Az infúziót azonnal le lehet állítani vagy csökkenteni lehet az adagot.
A sebesség csökkentésével vagy az infúzió leállításával ezek a tünetek általában elmúlnak.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Nagyon ritka (10 000 betegből legfeljebb 1 beteget érint): a Kabiven okozhat allergiás reakciót. Haladéktalanul tájékoztassa kezelőorvosát, ha:
· kiemelkedő és viszkető kiütések jelennek meg a testén
· nagyon magas a testhőmérséklete
· nehézlégzést tapasztal
Gyakori mellékhatások (100 betegből 1-10 beteget érint)
· enyhén emelkedett testhőmérséklet
· a véna gyulladása, amelybe az infúziót adták
Az alábbi nem gyakori (1000 betegből 1-10 beteget érint) mellékhatásokat figyelték meg
· hidegrázás
· fáradtság
· gyomorfájás
· fejfájás
· hányinger és hányás
· a májenzim szintek emelkedése. Kezelőrvosa közölni fogja Önnel, ha ez fennáll.
Egyéb nagyon ritka (10 000 betegből legfeljebb 1 beteget érint) mellékhatások
· magas vagy alacsony vérnyomás
· légzési nehézség
· férfiaknál elhúzódó, fájdalmas erekció
· vérrel kapcsolatos problémák
Zsír-túltelítődési szindróma
A zsírfelhasználó képesség csökkenése esetén alakulhat ki, túl sok Kabiven alkalmazása esetén. Állapotában hirtelen bekövetkező változás (veseprobléma vagy fertőzés) esetén is előfordulhat.
Lehetséges tünetei a láz, a zsírszint megemelkedése a vérben, a sejtekben és a szövetekben, különböző szervekben jelentkező eltérések és kóma. E tünetek mindegyike általában eltűnik, ha az infúziót leállítják.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Kabivent tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A Kabiven megfelelő tárolásáért, felhasználásáért és hulladékártalmatlanításáért a kezelőorvos és a kórház gyógyszerésze felelős. Legfeljebb 25˚C-on tárolandó. Nem fagyasztható! A tartályt mindig tartsa a dobozában.
A címkén feltüntetett lejárati idő (Felhasználható) után nem alkalmazható az emulzió.
Ne használja fel, ha csomagolás sérült.
Kizárólag egyszeri alkalmazásra. A megmaradt emulziót a kórházi előírásoknak megfelelően kell megsemmisíteni.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Kabiven?
A Kabiven egy három rekeszből álló infúziós zsákban kerül forgalomba. Minden infúziós zsák az alábbi, különböző térfogatmennyiségeket tartalmazza, a négy kiszerelés méretétől függően:
|
1026 ml |
1540 ml |
2053 ml |
2566 ml |
|
|
Glükóz 19% oldat |
526 ml |
790 ml |
1053 ml |
1316 ml |
|
Vamin 18 Novum aminosav oldat elektrolitokkal |
300 ml |
450 ml |
600 ml |
750 ml |
|
Zsíremulzió (Intralipid 20%) |
200 ml |
300 ml |
400 ml |
500 ml |
|
A készítmény hatóanyagai |
||||
|
Tisztított szójababolaj |
100g |
80 g |
60 g |
40 g |
|
Glükóz (vízmentes) |
250 g |
200 g |
150 g |
100 g |
|
Aminosavak |
||||
|
Alanin |
12,0 g |
9,6 g |
7,2 g |
4,8 g |
|
Arginin |
8,5 g |
6,8 g |
5,1 g |
3,4 g |
|
Aszparaginsav |
2,6 g |
2,0 g |
1,5 g |
1,0 g |
|
Glutaminsav |
4,2 g |
3,4 g |
2,5 g |
1,7 g |
|
Glicin |
5,9 g |
4,7 g |
3,6 g |
2,4 g |
|
Hisztidin |
5,1 g |
4,1 g |
3,1 g |
2,0 g |
|
Izoleucin |
4,2 g |
3,4 g |
2,5 g |
1,7 g |
|
Leucin |
5,9 g |
4,7 g |
3,6 g |
2,4 g |
|
Lizin |
6,8 g |
5,4 g |
4,1 g |
2,7 g |
|
Metionin |
4,2 g |
3,4 g |
2,5 g |
1,7 g |
|
Fenilalanin |
5,9 g |
4,7 g |
3,6 g |
2,4 g |
|
Prolin |
5,1 g |
4,1 g |
3,1 g |
2,0 g |
|
Szerin |
3,4 g |
2,7 g |
2,0 g |
1,4 g |
|
Treonin |
4,2 g |
3,4 g |
2,5 g |
1,7 g |
|
Triptofán |
1,4 g |
1,1 g |
0,86 g |
0,57 g |
|
Tirozin |
0,17 g |
0,14 g |
0,10 g |
0,07 g |
|
Valin |
5,5 g |
4,4 g |
3,3 g |
2,2 g |
|
Vízmentes nátrium-glicerofoszfát |
3,8 g |
3,0 g |
2,3 g |
1,5 g |
|
Kalcium-klorid |
0,56 g |
0,44 g |
0,33 g |
0,22 g |
|
Kálium-klorid |
4,5 g |
3,6 g |
2,7 g |
1,8 g |
|
Magnézium-szulfát |
1,2 g |
0,96 g |
0,72 g |
0,48 g |
|
Nátrium-acetát |
3,7 g |
2,9 g |
2,2 g |
1,5 g |
Ennek megfelelően
|
g / 1000 ml |
|
|
· Aminosavak |
33 g |
|
· Nitrogén |
5,3 g |
|
· Zsírok |
39 g |
|
· Szénhidrátok |
|
|
- Glükóz (vízmentes) |
97 g |
|
Energiatartalom |
|
|
- teljes |
910 kcal |
|
- nem fehérjéből származó |
780 kcal |
|
· Elektrolitok |
|
|
- nátrium |
31 mmol |
|
- kálium |
23 mmol |
|
- magnézium |
4 mmol |
|
- kalcium |
2 mmol |
|
- foszfát |
9,7 mmol |
|
- szulfát |
4 mmol |
|
- klorid |
45 mmol |
|
- acetát |
38 mmol |
|
Ozmolalitás |
kb. 1230 mosm / kg víz |
|
Ozmolaritás |
kb. 1060 mosm / l |
|
pH |
kb. 5,6 |
Egyéb összetevők:
tisztított tojás-foszfolipidek, glicerin, nátrium-hidroxid, injekcióhoz való víz.
Milyen a Kabiven emulziós infúzió külleme és mit tartalmaz a csomagolás
A glükóz és az aminosav oldatok tiszták és színtelenek vagy sárgás színűek, a zsíremulzió fehér. A Kabiven háromrekeszes zsákból, illetve egy külső borításból áll. A belső és a külső zsák között egy oxigénmegkötő található. A belső zsák három egymástól felszakítható hegesztéssel elválasztott rekeszből áll. A három rekesz tartalmát a beadás előtt elegyíteni kell a felszakítható hegesztés felnyitásával.
A Kabiven 2 x 2566 ml-es Excel típusú, 2 x 2053 ml-es Excel típusú , ill. 4 x 2053 ml-es Biofine típusú zsákban, 3 x 2566 ml-es Biofine típusú zsákban, 4 x 1540 ml, 4 x 1026 ml-es zsákban kapható.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A forgalombahozatali engedély jogosultja és a gyártó
A forgalombahozatali engedély jogosultja:
Fresenius Kabi AB, SE-751 74 Uppsala, Rapstagan 7, Svédország
Gyártók:
Fresenius Kabi AB, SE-751 74 Uppsala, Rapstagan 7, Svédország
Fresenius Kabi Austria GmbH, A-8055 Graz, Hafnerstrasse 36, Ausztria
OGYI-T-8356/01 (Kabiven emulziós infúzió 4 x 1026 ml, Excel zsák)
OGYI-T-8356/02 (Kabiven emulziós infúzió 4 x 1540 ml, Excel zsák)
OGYI-T-8356/03 (Kabiven emulziós infúzió 2 x 2053 ml, Excel zsák)
OGYI-T-8356/04 (Kabiven emulziós infúzió 2 x 2566 ml, Excel zsák)
OGYI-T-8356/05 (Kabiven emulziós infúzió 4 x 1026 ml, Biofine zsák)
OGYI-T-8356/06 (Kabiven emulziós infúzió 4 x 1540 ml, Biofine zsák)
OGYI-T-8356/07 (Kabiven emulziós infúzió 4 x 2053 ml, Biofine zsák)
OGYI-T-8356/08 (Kabiven emulziós infúzió 3 x 2566 ml, Biofine zsák)
A betegtájékoztató legutóbbi felülvizsgálatának dátuma: 2015. május
Az alábbi információk kizárólag egészségügyi szakembereknek szólnak:
Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések
A túl gyors infúzió beadás kockázatának elkerülése céljából, folyamatos és jól kontrollált infundálás javasolt, lehetőleg volumetriás pumpa alkalmazásával.
Valamennyi centrális véna igénybevétele esetén fokozott a fertőzés kockázata, ezért a kanül behelyezése és a vele kapcsolatos tevékenységek alkalmával a kontamináció elkerülés érdekében szigorúan aszeptikus körölményeket kell biztosítani..
A szérum glükóz- és elektrolitszintek, az ozmolaritás, valamint a folyadék- és savbázis egyensúly és a májenzimek rendszeres mérése szükséges.
Súlyos anafilaxiás reakcióra utaló bármilyen jel vagy tünet esetén az infúzió adását azonnal fel kell függeszteni.
A Kabiven emulziót nem szabad egyszerre vérrel vagy vérkészítménnyel ugyanazon az infúziós szereléken keresztül adni, a pszeudoagglutináció kockázata miatt.
Az alkalmazás módja
Intravénás alkalmazás, centrális vénába.
A teljes parenterális táplálás biztosítása érdekében nyomelemeket, vitaminokat és szükség esetén elektrolitokat (a Kabiven elektrolit tartalmának figyelembe vételével) kell a Kabivenhez adni, a beteg szükségleteinek megfelelően.
Az infúzió sebessége
Az infúzió maximális sebessége a glükóz esetén 0,25 g/ttkg/óra.
Az aminosav adagja nem haladhatja meg a 0,1 g/ttkg/órát.
A zsír dózisa nem lehet több, mint 0,15 g/ttkg/óra.
Az infúzió sebessége nem lehet több, mint 2,6 ml/ttkg/óra (ami megfelel 0,25 g glükóznak, 0,09 g aminosavnak és 0,1 g zsírnak, testtömeg-kilogrammonként).
Az infúzió beadásának ajánlott időtartama 12-24 óra.
A felhasználásra vonatkozó figyelmeztetés
Nem szabad felhasználni, ha sérült a csomagolás. A Kabivent csak akkor szabad összekeverni és felhasználni, ha az aminosav és glükóz oldatok tiszták és színtelenek vagy kissé sárgák, és ha az emulzió fehér és homogén. A három különálló rekesz tartalmát a beadás, illetve bármilyen adalék hozzáadása előtt össze kell keverni.
A hegesztések felnyílása után a zsákot háromszor meg kell forgatni, annak érdekében, hogy a fázisok szétválásának jelei nélküli, homogén elegyet kapjon.
Kizárólag egyszeri alkalmazásra. A összes megmaradt infúziós keveréket meg kell semmisíteni.
Kompatíbilitás
Csak olyan gyógyszer- vagy tápoldatok adhatók a Kabivenhez, amelyek kompatibilitása bizonyított. A különböző adalékanyagok kompatíbilitása és a tárolási idők kérésre rendelkezésre állnak.
Az adalékanyagok hozzáadását aszeptikus körülmények között kell végezni.
Felhasználhatósági időtartam
Felhasználhatósági időtartam összekeverés után:
A zárórétegek felszakadása után a készítmény felhasználás közbeni kémiai és fizikai stabilitása 24 órán keresztül 25°C hőmérsékleten bizonyított.
Felhasználhatósági időtartam adalékanyagokkal történő összekeverés után
A felszakítható, hegesztett zárórétegek kinyitása és a három oldat összekeverése után a gyógyszeradagoló nyíláson keresztül adalékanyagok juttathatók be az infúzióba.
Mikrobiológiai szempontból az infúziót az adalékanyagok hozzáadása után azonnal fel kell használni. Ha ez nem történik meg rögtön, a beadásra kész oldat felhasználást megelőző tárolási idejéért és annak körülményeiért a felhasználó a felelős, de az rendes körülmények között 2-8°C-os hőmérsékleten nem lehet hosszabb, mint 24 óra. Ha a tárolás elkerülhetetlen, és biztosított, hogy az adalékanyagok hozzáadása ellenőrzött és bizonyítottan aszeptikus körülmények között történt, az összekevert emulziót a beadás előtt 2-8°C közötti hőmérsékleten maximum 6 napig lehet tárolni.
A 2-8°C-os tárolóhelyről történt kivétel után a keveréket 24 órán belül kell beadni.
Használati utasítás
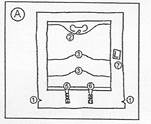
Excel zsák leírása:

1. Bevágások a védőborításon
2. Nyílás a felfüggesztéshez
3. Felszakítható hegesztések
5. Adalék csatlakozó
6. Infúziós szerelék csatlakozó
7. Oxigén abszorber
|
Műveletek leírása: |
|
|
1. A külső csomagolás eltávolításához tartsa a zsákot egyenesen és tépje le a jelöléstől a felső széléig, majd egyszerűen tépje fel a hosszú oldalt, vegye le a műanyag borítást és dobja ki az oxigén abszorberrel együtt.
|
|
|
2. Összekeverés Helyezze a zsákot - a külső csomagolással együtt, vagy anélkül - vízszintes felületre. Tekerje fel a zsákot a felületen a fogantyú használatával, míg a hegesztések felnyílnak. Keverje össze alaposan a zsák forgatásával.
|
|
|
3. Adalék hozzáadása: Mielőtt bármilyen adalékot injektálna, tisztítsa meg a bevezető csatlakozást fertőtlenítővel. Tartsa szilárdan a bevezető csatlakozást. Szúrja át a csatlakozó membránját. Teljesen vezesse be a tűt és injektálja az (ismert kompatibilitású) adalékokat az injektálási hely középpontján át. Minden adalék hozzáadása közben alaposan keverje össze a zsák többszöri forgatásával. Közvetlenül az adalékok hozzáadása előtt fordítsa el a fehér színű csatlakozó garanciazáras záróelemét. |
|
|
4. Infúziós szerelék csatlakoztatása: Használjon nem-szellőző infúziós szereléket, vagy zárja be a légbeeresztőt a szellőző szereléken. Távolítsa el a szerelék csatlakozás fedelét felfelé húzva a gyűrűt. Tartsa szilárdan a csatlakozót. Az infúziós szerelék hegyét teljes hosszában szúrja át a csatlakozó membránján. Csavaró mozdulattal megkönnyítheti a membrán átszúrását. Az infúziós szerelék hegyének teljes beszúrása biztosítja a szerelék megfelelő rögzítését. Közvetlenül az infúziós szerelék csatlakozása előtt fordítsa el a kék színű csatlakozó garanciazáras záróelemét. |
|
|
5. Függessze fel a zsákot a fogantyú alatt lévő nyíláson át.
|
|
Biofine zsák leírása:
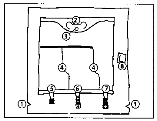
|
1. A külső csomagolás eltávolítása • A külső csomagolás eltávolításához tartsa a zsákot egyenesen és tépje le a jelöléstől a felső széléig, (A), • majd egyszerűen tépje fel a hosszú oldalt, vegye le a műanyag borítást és dobja ki az oxigén abszorberrel együtt (B).
|
|
|
2. Összekeverés • Helyezze a zsákot vízszintes felületre. • Tekerje fel a zsákot először jobb kézzel szorosan a fogantyú felől (a zsír felőli oldalról) a csatlakozók irányába, majd bal kézzel erőteljes nyomást alkalmazzon, míg a függőleges hegesztések felnyílnak. A függőleges hegesztések a folyadékra alkalmazott nyomás hatására felnyílnak. A hegesztések a külső csomagolás eltávolítása nélkül is felnyílnak. Figyelmeztetés: A zsák kinyitása során a vízszintes hegesztés zárva marad; így is teljes az összekeverés.
|
|
|
• Keverje össze a három kamra tartalmát úgy, hogy háromszor forgassa meg a zsákot, míg a tartalma teljesen összeelegyedik.
|
|
|
3. Az előkészítés befejezése • Helyezze a zsákot ismét vízszintes felületre. Közvetlenül az adalékok hozzáadása előtt törje le a fehér színű csatlakozó garanciazáras záróelemét (A). Figyelmeztetés: Az adalék csatlakozó membránja steril. • Tartsa szilárdan az adalék csatlakozót. Szúrja át a csatlakozó membránját, injektálja az (ismert kompatibilitású) adalékokat az injektálási hely középpontján át. • Minden adalék hozzáadása után alaposan keverje össze a zsákot, háromszor megforgatva. A fecskendőhöz használt tű mérete 18-23 legyen és a tű hossza max. 40 mm.
|
|
|
• Közvetlenül az infúziós szerelék csatlakozása előtt törje le a kék színű csatlakozó garanciazáras záróelemét. (A). Figyelmeztetés: Az infúziós szerelék csatlakozójának membránja steril. • Használjon nem-szellőző infúziós szereléket, vagy zárja be a légbeeresztőt a szellőző szereléken. • Tartsa szilárdan a csatlakozót. • Az infúziós szerelék hegyét teljes hosszában szúrja át a csatlakozó membránján. Az infúziós szerelék hegyének teljes beszúrása biztosítja a szerelék megfelelő rögzítését. Figyelmeztetés: Az infúziós szerelék csatlakozójának belső része steril.
|
|
|
4. A zsák felfüggesztése • Függessze fel a zsákot a fogantyú alatt lévő nyíláson át.
|
|