BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
Eligard 22,5 mg por és oldószer oldatos injekcióhoz
leuprorelin-acetát
Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos információkat tartalmaz.
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
- További kérdéseivel forduljon kezelőorvosához, gyógyszerészéhez vagy a gondozását végző egészségügyi szakemberhez.
- Ezt a gyógyszert az orvos kizárólag Önnek írta fel. Ne adja át a készítményt másnak, mert számára ártalmas lehet még abban az esetben is, ha tünetei az Önéhez hasonlóak.
- Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd 4. pont.
A betegtájékoztató tartalma
1. Milyen típusú gyógyszer az Eligard és milyen betegségek esetén alkalmazható?
2. Tudnivalók az Eligard alkalmazása előtt
3. Hogyan kell alkalmazni az Eligard‑ot?
4. Lehetséges mellékhatások
5 Hogyan kell az Eligard‑ot tárolni?
6. A csomagolás tartalma és egyéb információk
7. Egészségügyi szakembernek szóló információk
1. MILYEN TÍPUSÚ GYÓGYSZER AZ ELIGARD ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
Az Eligard hatóanyaga az ún. gonadotropin-felszabadító hormonok csoportjába tartozik. Ezeket a gyógyszereket bizonyos nemi hormonok (pl. a tesztoszteron) termelődésének csökkentésére használják.
Az Eligard‑ot felnőtt férfiak hormonfüggő, áttétes prosztatarákjának, valamint magas kockázatú, nem‑áttétes, hormonfüggő prosztatarákjának kezelésére alkalmazzák, sugárterápiával kombinálva.
2. TUDNIVALÓK AZ ELIGARD ALKALMAZÁSA ELŐTT
Ne alkalmazza az Eligard-ot
- ha Ön nő vagy gyermek.
- ha túlérzékeny (allergiás) a hatóanyagra, a leuprorelin-acetátra, a természetes gonadtropin hormonhoz hasonló hatású készítményekre, vagy az Eligard (6. pontban felsorolt) egyéb összetevőire.
- heréinek sebészi úton történt eltávolítása után, ugyanis ilyen esetben az Eligard nem okoz további tesztoszteronszint-csökkenést.
- egyedüli kezelésként, amennyiben Ön a gerincvelőt érintő nyomás vagy a gerincben lévő daganat következtében jelentkező tünetektől szenved. Ilyen estekben az Eligard csak egyéb, a prosztatadaganat kezelésére szánt gyógyszerekkel kombinációban alkalmazható.
Figyelmeztetések és óvintézkedések
Az Eligard alkalmazása előtt közölje kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel, ha az alábbiak közül bármelyik fennáll Önnél:
- Ha bármilyen szív- és érrendszeri betegsége, pl. szívritmuszavara (aritmia) van, vagy ha ilyen betegségek kezelésére szolgáló gyógyszereket szed. Az Eligard alkalmazása során fokozódhat a szívritmuszavarok előfordulásának kockázata.
- Ha vizelési nehézségekkel küzd. Ebben az esetben – a kezelés első heteiben – Önt fokozott megfigyelés alatt kell tartani.
- Ha a gerincvelőre gyakorolt nyomás vagy vizelési nehézség alakul ki. Az Eligrard‑hoz hasonló hatásmechanizmussal rendelkező egyéb gyógyszerek alkalmazásával kapcsolatban a gerincvelőre gyakorolt nyomóhatás súlyos eseteit, a vesék és a húgyhólyag közötti húgyvezeték beszűkülését jelentették, amelyek bénulásszerű tüneteket okozhatnak. Ha ilyen szövődmények lépnek fel, a szokásos kezelést kell kezdeni.
- Ha hirtelen fejfájást, hányást, megváltozott szellemi állapotot tapasztal, és néha elájul a szív rendellenes működése miatt az Eligard beadását követő két héten belül, kérjük, értesítse a kezelőorvosát vagy az orvosi kisegítő személyzetet. Ezek a tünetek egy ritka agyalapi mirigy‑elváltozásra (hipofizis apoplexiára) utalnak, melyet az Eligard-hoz hasonló hatásmechanizmussal rendelkező EGYÉB GYÓGYSZEREKNÉL figyeltek meg.
- Ha cukorbetegségben szenved (magas a vércukorszintje). Az Ön állapotát a kezelés alatt rendszeresen ellenőrizni kell.
- Az Eligard‑kezelés fokozhatja a csonttörések kockázatát a csontritkulás (oszteoporózis) következtében.
- Eligard‑dal kezelt betegeknél depressziót jelentettek. Ha Ön Eligard‑kezelésben részesül és depressziós hangulata alakul ki, értesítse kezelőorvosát.
- Azoknál a betegeknél, akik az Eligard‑ hoz hasonló készítményeket szedtek, szív- érrendszeri eseményeket jelentettek, melyekről nem ismert, hogy összefüggésben hozhatók ezekkel a készítményekkel. Ha Ön Eligard‑ot alkalmaz és szív-érrendszeri jeleket vagy tüneteket észlel, értesítse kezelőorvosát.
- Eligard alkalmazása után görcsrohamok előfordulását jelentették a betegeknél. Ha Eligard‑kezelést kap és görcsrohamok jelentkeznek Önnél, értesítse kezelőorvosát.
A kezelés kezdetén jelentkező szövődmények
A kezelés első hetében általában rövid időre megemelkedik a férfi nemihormon, a tesztoszteron vérszintje, mely a betegséggel kapcsolatos tünetek átmeneti rosszabbodásához és korábban nem észlelt új tünetek megjeleneséhez vezethet. Ezek közé főként a csontfájdalom, vizelési zavarok, gerincvelőre gyakorolt nyomás vagy véres vizelet tartozik. Ezen panaszok a kezelés folytatásával rendszerint enyhülnek vagy megszűnnek. Amennyiben a panaszok nem enyhülnek, keresse fel kezelőorvosát.
Ha az Eligard nem eredményez javulást
A betegek egy részének olyan daganata van, amely nem érzékeny a szérum tesztoszteronszintjének csökkenésére. Kérjük, mondja el kezelőorvosának, ha az Eligard hatását túlzottan csekélynek találja.
Egyéb gyógyszerek és az Eligard
Az Eligard befolyásolhatja egyes, szívritmuszavarok kezelésére szolgáló gyógyszerek (például kinidin, prokainamid, amiodaron és szotalol) hatását, illetve megnövelheti a szívritmuszavarok kockázatát más gyógyszerekkel együtt alkalmazva [például metadon (fájdalomcsillapításra és kábítószer-függőség esetén a méregtelenítés részeként alkalmazzák), moxifloxacin (egy antibiotikum), súlyos elmebetegségek kezelésére alkalmazott antipszichotikumok].
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Termékenység, terhesség és szoptatás
Az Eligard nem nők kezelésére szánt gyógyszer.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A fáradtság, a szédülés és a látási zavarok az Eligard‑kezelés lehetséges mellékhatásai, de a betegségből eredően is jelentkezhetnek. Ezen mellékhatások fennállása esetén legyen fokozottan óvatos, ha gépjárművet vezet vagy veszélyes gépeket kezel.
3. HOGYAN KELL ALKALMAZNI AZ ELIGARD-OT?
Adagolás
A gyógyszert mindig a kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően
alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Ha az orvos másképp nem rendeli, az Eligard 22,5 mg-ot három havonta egyszer kell alkalmazni.
A befecskendezett oldat hatóanyagraktárat képez, amelyből a leuprorelin‑acetát hatóanyag folyamatos leadása három hónapon át tart.
További vizsgálatok
Orvosának bizonyos meghatározott klinikai vizsgálati értékek és az ún. prosztataspecifikus‑antigén (PSA) vérszintjének meghatározásával ellenőriznie kell, hogy az Eligard‑kezelés hatékony‑e Önnél.
Az alkalmazás módja
Az Eligard‑ot csak az Ön kezelőorvosa vagy az egészségügyi szakszemélyzet adja be. Ugyancsak ők gondoskodnak a felhasználásra kész oldat elkészítéséről (az „Egészségügyi szakembernek szóló információk” című 7. pontnak megfelelően, amely a mellékelt betegtájékoztató végén található).
Elkészítés után az Eligard‑ot a bőr alatti szövetekbe kell fecskendezni (szubkután injekció). Artériába vagy vénába történő fecskendezése szigorúan kerülendő!
Mint minden egyéb hatóanyag esetében, melyet bőr alá fecskendeznek, a beadás helyét rendszeresen változtatni kell.
Ha az előírtnál több Eligard-ot kapott
Mivel az injekció beadását általában az orvosa vagy szakképzett személy végzi, ezért túladagolás nem valószínű.
Ha mindezek ellenére az előírtnál nagyobb adag beadására került sor, akkor kezelőorvosa külön megfigyeli Önt és szükség esetén kiegészítő kezelést nyújt Önnek.
Ha elfelejtették Önnél alkalmazni az Eligard‑ot
Kérjük forduljon kezelőorvosához, ha úgy gondolja, hogy a három havonta alkalmazandó Eligard esedékes adagjának alkalmazását elfelejtették.
Az Eligard‑kezelés befejezésekor jelentkező hatások
Általános szabály, hogy prosztatadaganat esetén hosszú ideig tartó Eligard‑kezelés szükséges. Ennek megfelelően a kezelést még abban az esetben sem szabad abbahagyni, ha a tünetek javulnak vagy teljesen megszűnnek.
Az Eligard‑kezelés idő előtti abbahagyása esetén a betegségre jellemző tünetek rosszabbodhatnak.
A kezelést az orvossal történő előzetes megbeszélés nélkül nem szabad idő előtt megszakítania.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét vagy a gondozását végző egészségügyi szakembert.
4. LEHETSÉGES MELLÉKHATÁSOK
Mint minden gyógyszer, így az Eligard is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Az Eligard‑kezelés során megfigyelt mellékhatások főleg a hatóanyag, a leuprorelin‑acetát, specifikus hatásának, nevezetesen bizonyos hormonszintek emelkedésének vagy csökkenésének tulajdoníthatók. A leggyakrabban leírt mellékhatások a hőhullámok (a betegek 58%‑ánál), a hányinger, a rossz közérzet és a fáradtság, valamint az injekció beadási helyén jelentkező átmeneti, helyi irritáció.
Kezdeti mellékhatások
Az Eligard‑kezelés első heteiben a betegségre jellemző tünetek rosszabodhatnak, mert általában a kezelés kezdetén a férfi nemihormon, a tesztoszteron szintje rövid időre megemelkedik a vérben. Ezért kezelőorvosa a kezelés kezdeti fázisában egy megfelelő antiadrogént (egy olyan anyagot mely gátolja a tesztoszteron hatását) adhat, hogy csökkentse a készítmény alkalmazása után jelentkező tüneteket (lásd még: 2. pont „Tudnivalók az Eligard alkalmazása előtt”, „A kezelés kezdetén jelentkező szövődmények”).
Az alkalmazás helyén jelentkező mellékhatások
Az Eligard befecskendezése után megfigyelt helyi mellékhatások tipikusan megfelelnek azoknak, amelyek a hasonló, bőr alá fecskendezett készítményeknél gyakran előfordulnak. Az injekciózás után jelentkező enyhe égő érzés nagyon gyakori. Szúró érzés és fájdalom, valamint véraláfutás a beadás helyén gyakran előfordul. Gyakran számoltak be az injekció beadásának helyén jelentkező bőrpírról. A szövet megkeményedése és a kifekélyesedés nem gyakori.
A bőr alá történt beadás után jelentkező helyi mellékhatások enyhék és rövid ideig tartanak, és a két injekció beadása közötti időszakban nem ismétlődnek.
Nagyon gyakori mellékhatások (10-ből több mint 1 beteget érinthet):
· hőhullámok
· a bőr és a nyálkahártya ok nélküli vérzése, bőrpír
· fáradtság, a beadás helyén jelentkező mellékhatások (lásd még fentebb az alkalmazás helyén jelentkező mellékhatásokat)
Gyakori mellékhatások (100-ból 1-10 beteget érinthet):
· orrgaratgyulladás (megfázásos tünetek)
· hányinger, rossz közérzet, hasmenés, gyomor- és bél gyulladás (gasztroenteritisz/kolitisz)
· viszketés, éjszakai verítékezés
· ízületi fájdalom
· rendszertelen vizeletürítés (éjszaka is), vizeletürítési nehézség, fájdalmas vizelés, csökkent vizeletmennyiség
· az emlő érzékenysége és duzzanata, heresorvadás, herefájdalom, terméketlenség, merevedési zavarok, a hímvessző méretének csökkenése
· merev állapotok (magas lázzal kísért túlzott remegéses epizódok), gyengeség
· megnyúlt véralvadási idő, változások a vér laboratóriumi jellemzőiben, a vörösvértestek csökkenése/alacsony vörösvértest szám
Nem gyakori mellékhatások (100-ból legfeljebb 1 beteget érinthet):
· húgyúti fertőzések, helyi bőrfertőzések
· a cukorbetegség rosszabbodása
· szokatlan álmok, depresszió, csökkent nemi vágy
· szédülés, fejfájás, a bőrérzékelés megváltozása, álmatlanság, íz- és szagérzékelési zavar
· magas vérnyomás, alacsony vérnyomás
· légszomj
· székrekedés, szájszárazság, emésztési zavarok (tünetei: a gyomor teltségérzése, gyomorfájdalom, böfögés, hányinger, hányás, gyomorégés), hányás
· nyirkos bőr, fokozott verítékezés
· hátfájás, izomgörcsök
· véres vizelet
· hólyaggörcs, gyakori vizeletürítés, vizeletürítési képtelenség
· a férfi emlőszövet megnagyobbodása, impotencia
· levertség (álmosság), fájdalom, láz
· testtömeg-növekedés
· egyensúlyvesztés, szédülés
· izomvesztés/az izomszövet csökkenése hosszú távú kezelést követően
Ritka mellékhatások (1000-ből legfeljebb 1 beteget érinthet):
· kóros akaratlan mozgások
· hirtelen eszméletvesztés, ájulás
· bélgázosság, böfögés
· hajhullás, bőrkiütés
· emlőfájdalom
· fekély az injekció beadása helyén
Nagyon ritka mellékhatások (10 000-ből legfeljebb 1 beteget, érinthet):
· szövetelhalás az injekció beadása helyén
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem állapítható meg):
· EKG-elváltozások (QT-szakasz megnyúlása)
· tüdőgyulladás, tüdőbetegség
Egyéb mellékhatások
Az Eligard hatóanyagával, a leuprorelin‑acetáttal kapcsolatban a szakirodalomban leírt egyéb mellékhatások: ödéma (folyadékgyülem a szövetekben, ami a kezek és lábak duzzadásaként jelentkezik), tüdőembólia (amely olyan tüneteket okoz, mint a légszomj, légzési nehézség és mellkasi fájdalom), szívdobogásérzés, izomgyengeség, borzongás, bőrkiütés, emlékezetzavar és látászavar. Az Eligard hosszú távú alkalmazása esetén növekvő számban fordulhatnak elő a csontsűrűség csökkenésére (csontritkulásra) utaló jelek. A csontritkulás következtében a csonttörések kockázata növekszik.
Ritkán súlyos allergiás reakciókat, melyek légzési nehézséget vagy szédülést okoznak, jelentettek az Eligard-dal azonos gyógyszercsoportba tartozó készítmények alkalmazása után.
Az Eligard-dal azonos gyógyszercsoportba tartozó készítmények alkalmazása után görcsrohamok előfordulásáról számoltak be.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. HOGYAN KELL AZ ELIGARD-OT TÁROLNI?
A gyógyszer gyermekektől elzárva tartandó!
A külső csomagoláson feltüntetett lejárati idő (Exp: ) után nem alkalmazható. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Különleges tárolási előírások
Hűtőszekrényben (2 °C – 8 °C-on), nedvességtől való védelem érdekében az eredeti csomagolásban tárolandó.
Az injekció beadása előtt a készítménynek szobahőmérsékletűnek kell lennie. 30 perccel a felhasználás előtt vegyük ki a hűtőszekrényből. Hűtőszekrényen kívül a készítmény eredeti csomagolásban, szobahőmérsékleten (25 °C alatt) legfeljebb négy hétig tárolható.
A tálca felbontása után a gyógyszert azonnal el kell készíteni és fel kell használni. Az elkészített gyógyszerkészítmény kizárólag egyszer használható fel.
A fel nem használt vagy lejárt Eligard megsemmisítésére vonatkozó előírások
A gyógyszereket nem szabad a szennyvízzel vagy a háztartási hulladékkal együtt megsemmisíteni. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb INFORMÁCIÓK
Mit tartalmaz az Eligard?
- A készítmény hatóanyaga a leuprorelin-acetát.
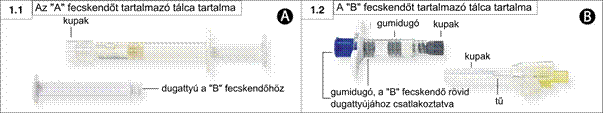
Egy előretöltött injekciós fecskendő („B” fecskendő) 22,5 mg leuprorelin-acetátot tartalmaz.
- Egyéb összetevők: poli-(DL-laktát-ko-glikolsav) (72:25) és a N-metil-pirrolidon
az oldószert tartalmazó előretöltött injekciós fecskendőben („A” fecskendő).
Milyen az Eligard készítmény külleme és mit tartalmaz a csomagolás?
Az Eligard tartalmaz egy port és oldószert az oldatos injekcióhoz.
Az Eligard az alábbi kiszerelésekben érhető el:
- Hőformált tálcás csomagolás, amely két hőformált tálcát tartalmaz egy kartondobozban. Az egyik tálca egy előretöltött fecskendőt („A” fecskendő), egy a „B” fecskendőhöz szükséges nagy dugattyúrudat és egy nedvességmegkötő tasakot tartalmaz. A másik tálca egy előretöltött fecskendőt („B” fecskendő), egy 20 G‑s steril tűt és egy nedvességmegkötő tasakot tartalmaz.
- Gyűjtőcsomagolás, amely 2×2 db előretöltött fecskendőt (1‑1 db „A” és „B” fecskendő) tartalmaz.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A forgalomba hozatali engedély jogosultja
Astellas Pharma Kft.
Csörsz u. 49-51.
1124 Budapest
Magyarország
Tel.: +36-1-577-8200
Fax: +36-1-209-3054
Gyártó
Astellas Pharma Europe B.V.
Sylviusweg 62
2333 BE Leiden
Hollandia
Ezt a gyógyszert az Európai Gazdasági Térség tagállamaiban az alábbi neveken engedélyezték:
Ausztria: Eligard Depot 22.5 mg
Belgium: Depo-Eligard 22.5 mg
Bulgária: Eligard 22.5 mg
Ciprus: Eligard
Cseh Köztársaság: Eligard 22.5 mg
Dánia: Eligard
Észtország: Eligard
Finnország: Eligard
Franciaország: Eligard 22.5 mg
Hollandia: Eligard 7.5 mg
Izland: Eligard
Írország: Eligard 22.5 mg
Lengyelország: Eligard 7.5 mg
Lettország: Eligard 22.5mg
Litvánia: Eligard 22.5 mg
Luxemburg: Depo-Eligard 22.5 mg
Magyarország: Eligard 7,5 mg
Németország: Eligard 7.5 mg
Norvégia: Eligard
Olaszország: Eligard
Portugália: Eligard 22.5mg
Románia: Eligard 22.5 mg
spanyolország: Eligard Semestral 22.5 mg
Svédország: Eligard
Szlovákia: Eligard 7.5 mg
Szlovénia: Eligard 7.5 mg
OGYI-T-10010/03 1× (tálcás csomagolás)
OGYI-T-10010/04 2× (tálcás csomagolás)
A betegtájékoztató legutóbbi felülvizsgálatának dátuma: 2018. július
7. EGÉSZSÉGÜGYI SZAKEMBERNEK SZÓLÓ INFORMÁCIÓK
Hagyja, hogy a készítmény szobahőmérsékletűre melegedjen! Felhasználás előtt 30 perccel vegye ki a hűtőszekrényből!
Kérjük, először a beteget készítse elő az injekció beadásához, ezután az alábbi utasítás szerint készítse el a készítményt. Amennyiben a termék elkészítése nem a megfelelő technikával történik, nem szabad beadni, mivel előfordulhat, hogy a klinikai hatás elmarad a termék nem megfelelő feloldása miatt.
1. lépés: Nyissa ki a mindkét tálcát (a kis hólyaggal megjelölt sarkánál tépje le a fóliát), és tegye a tartalmát egy tiszta területre (az „A” fecskendőt [1.1 ábra] és a „B” fecskendőt [1.2 ábra] tartalmazó két tálca). Dobja ki a nedvességet megkötő anyagot tartalmazó tasakokat.

2. lépés: Húzza ki, de ne csavarja a „B” fecskendőből a kék színű rövid dugattyút és a szürke gumidugót, és dobja ki (2. ábra). Ne próbálja meg összekeverni a készítményt, amíg mindkét gumidugó a helyén van.

3. lépés: Óvatosan csavarja be a tartalék hosszabb fehér dugattyút a „B” fecskendőben bent maradt szürke gumidugóba (3. ábra).
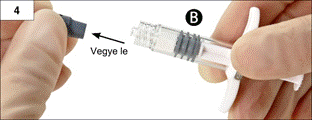
4. lépés: Vegye le a „B” fecskendőről a szürke gumikupakot és tegye le a fecskendőt (4. ábra).
 |
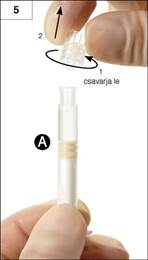
5. lépés: Tartsa az „A” fecskendőt függőleges helyzetben, hogy ne folyjon ki belőle a folyadék, és csavarja le a fecskendőről az átlátszó kupakot (5. ábra).
 |
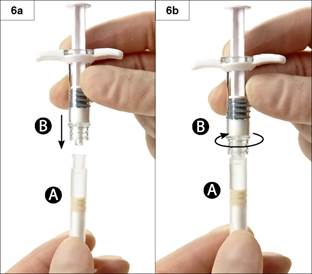
6. lépés: Csatlakoztassa egymáshoz a két fecskendőt, úgy, hogy a „B” fecskendőt rányomja és rácsavarja az „A” fecskendőre, amíg stabil nem lesz (6a és 6b ábra). Ne csavarja túl!
 |
7. lépés: Fordítsa meg a csatlakoztatott fecskendőket és továbbra is tartsa őket függőleges helyzetben úgy, hogy a „B” fecskendő legyen alul. Közben fecskendezze át az „A’ fecskendőben lévő folyadékot a „B” fecskendőben lévő porra (leuprorelin-acetátra) (7. ábra).
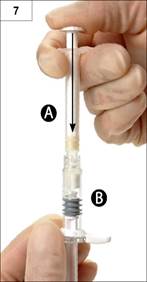 |
8. lépés: A vízszintes helyzetben tartott fecskendők tartalmának az egyik fecskendőből a másik fecskendőbe történő, óvatos oda-vissza fecskendezésével (összesen 60 alkalommal, amely kb. 60 másodpercig tart) alaposan keverje össze a készítményt, amíg homogén, viszkózus oldatot nem kap (8. ábra). Eközben ne hajlítsa meg a két fecskendőből álló rendszert (a fecskendők részleges szétcsatlakoztatása ugyanis szivárgást okozhat).
 |
Ha alaposan összekeveredett, akkor viszkózus folyadék képződik, aminek a színe színtelen, fehér vagy halványsárga lehet (a fehértől a halványsárgáig terjedő árnyalatokat is beleértve).
Figyelem: Ha a feloldás megtörtént: azonnal végezze el a következő lépést, mert az oldat viszkozitása az idő múlásával nő. Ne tárolja hűtőszekrényben az elkészített gyógyszert!
Figyelem: a készítményt a leírtak szerint kell összekeverni! A rázás NEM LESZ elegendő a készítmény megfelelő összekeveréséhez!
9. lépés: Tartsa a fecskendőket függőlegesen, úgy, hogy a „B” fecskendő legyen alul. A fecskendőknek továbbra is szorosan illeszkedniük kell egymáshoz. Az „A” fecskendő dugattyújának benyomásával és a „B” fecskendő dugattyújának enyhe húzásával juttassa át az összes összekevert készítményt a „B” fecskendőbe (a rövid, vastag fecskendő). (9. ábra)
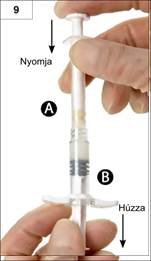
10. lépés: Válassza le az „A” fecskendőt, miközben a folyamatosan benyomva tartja az „A” fecskendő dugattyúját (10. ábra). Győződjön meg róla, hogy semmi nem folyt ki a készítményből, mert különben a tű nem illeszthető fel kellően szorosan.
Figyelem! A készítményben egy nagy vagy több kis levegőbuborék maradhat majd – ez elfogadható.
Ne nyomja ki a levegőbuborékokat a „B” fecskendőből, ugyanis így a készítményből is veszíthet!
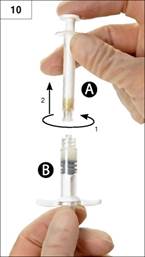 11. lépés:
11. lépés:
· Tartsa a „B” fecskendőt felfelé, és tartsa vissza a fehér színű dugattyút, hogy ne folyjon ki a készítmény.
· Nyissa ki a biztonsági tűt tartalmazó csomagot a hátoldalon található papír eltávolításával, majd vegye ki a biztonsági tűt.
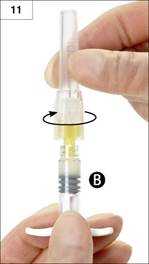
· Csatlakoztassa a biztonsági tűt a „B” fecskendő végéhez, úgy, hogy miközben tartja a fecskendőt, finoman az óramutató járásával megegyező irányba elfordítja a tűt körülbelül háromnegyed fordulattal, amíg a tű biztonságosan rögzül a fecskendőhöz. (11. ábra)
Ne csavarja túl, mert ettől elrepedhet a tű kónusza, és a készítmény kifolyhat az injekció beadásakor.
Ha a tű kónusza elrepedt, sérültnek látszik vagy szivárog, a készítmény nem használható fel. A sérült tűt nem szabad lecserélni, és a készítményt nem szabad beadni. A készítményt teljes egészében biztonságos módon meg kell semmisíteni.
Ha a tű kónusza sérült, egy új terméket kell helyette felhasználni.
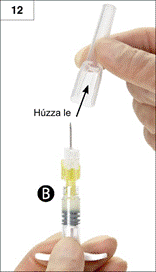
12. lépés: Az alkalmazás előtt húzza le a tűről a tűvédőt (12. ábra).
Figyelem: Alkalmazás előtt ne próbálgassa a biztonsági tűt!
 |
13. lépés: Alkalmazás előtt távolítsa el a nagy levegőbuborékokat a „B” fecskendőből. Bőr alá adja be a készítményt. Győződjön meg róla, hogy a „B” fecskendő teljes tartalmát beadta.
14. lépés: Az injekció beadása után zárja le a biztonsági védőpajzsot az alábbiakban leírt aktiváló módszerek egyikével.
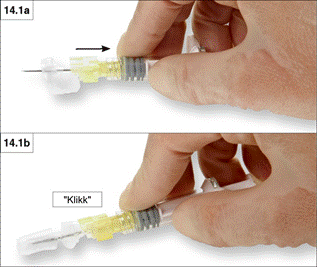
1. Lezárás egy sík felületen,
Nyomja meg a biztonsági védőpajzsot az emelőgombbal lefelé egy sík felületen (14.1a és 14.1b ábra), hogy lefedje a tűt és lezárja a védőpajzsot.
Úgy győződhet meg a zárt pozícióról, ha hallja és érzi a „kattanást”. Ekkor a védőpajzs teljesen lefedi a tűhegyet (14.1b ábra).
 |
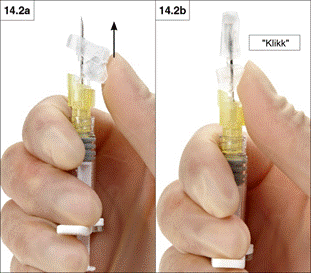
2. Hüvelykujjal történő lezárás
Helyezze hüvelykujját az emelőgomb fölé és csúsztassa fel a biztonsági védőpajzsot a tűhegy irányába (14.2a és 14.2b ábra), hogy lefedje a tűt és lezárja a védőpajzsot.
Úgy győződhet meg a zárt pozícióról, ha hallja és érzi a „kattanást”. Ekkor a védőpajzs teljesen lefedi a tűhegyet (14.2b ábra).
 |