Betegtájékoztató: Információk a felhasználó számára
SmofKabiven Peripheral emulziós infúzió
Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos információkat tartalmaz.
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
- További kérdéseivel forduljon kezelőorvosához, gyógyszerészéhez vagy a gondozását végző egészségügyi szakemberhez.
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. Lásd 4. pont.
A betegtájékoztató tartalma:
1. Milyen típusú gyógyszer a SmofKabiven Peripheral és milyen betegségek esetén alkalmazható?
2. Tudnivalók a SmofKabiven Peripheral alkalmazása előtt
3. Hogyan kell alkalmazni a SmofKabiven Peripheral‑t?
4. Lehetséges mellékhatások
5. Hogyan kell a SmofKabiven Peripheral‑t tárolni?
6. A csomagolás tartalma és egyéb információk
1. Milyen típusú gyógyszer a SmofKabiven Peripheral és milyen betegségek esetén alkalmazható?
A SmofKabiven Peripheral egy emulziós infúzió, melyet cseppenként (intravénás infúzió) juttatnak a vérbe. A készítmény aminosavakat (összetevők a fehérjék építéséhez), glükózt (szénhidrátok), lipideket (zsír) és sókat (elektrolitok) tartalmaz egy műanyag zsákban és felnőtteknél, valamint 2 éves és annál idősebb gyermekeknél alkalmazható.
A SmofKabiven Peripheral-t egészségügyi szakember fogja Önnek beadni, ha a táplálás más formája nem elég jó vagy nem működik.
2. Tudnivalók a SmofKabiven Peripheral alkalmazása előtt
Nem alkalmazható a SmofKabiven Peripheral,
- ha allergiás a hatóanyagokra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére
- ha allergiás a halra vagy a tojásra
- ha allergiás a földimogyoróra vagy a szójára, nem szabad alkalmazni ezt a készítményt. A SmofKabiven Peripheral szójababolajat tartalmaz.
- ha a vérének túl magas a lipidtartalma (hiperlipidémia)
- ha súlyos májbetegsége van
- ha véralvadási rendellenessége van (koagulációs rendellenesség)
- ha az Ön aminosav‑anyagcseréje nem megfelelő
- ha súlyos vesebetegsége van, és nincs lehetőség művese‑kezelésre
- heveny sokk esetén
- ha a vérének túl magas a cukor tartalma (hiperglikémia) és ez nincs kontrollálva
- ha a SmofKabiven Peripheral-ban található sók (elektrolitok) bármelyikének szintje kórosan magas az Ön vérében (szérumában)
- ha víz van a tüdejében (heveny tüdőödéma)
- ha túl sok a víz a testében (hiperhidratált állapot)
- ha kezeletlen szívelégtelensége van
- ha károsodott a véralvadási rendszere (hemofagocitózis szindróma)
- ha az Ön állapota instabil, pl. súlyos sérülés utáni állapotok, nem beállított cukorbetegség, heveny szívinfarktus, sztrók, vérrög, a vér vegyhatásának savas irányba történő eltolódása (metabolikus acidózis), súlyos vérmérgezés (szepszis), kóma esetén, illetve ha nincs elég folyadék a testében (hipotóniás dehidráció)
- 2 évesnél fiatalabb gyermekek esetében.
Figyelmeztetések és egyéb óvintézkedések
A SmofKabiven Peripheral alkalmazása előtt beszéljen kezelőorvosával, ha Önnél a következő problémák valamelyike fennáll:
- vesebetegség
- cukorbetegség
- hasnyálmirigy-gyulladás (pankreatitisz)
- máj problémák
- pajzsmirigy problémák (hipotireózis– a pajzmirigy csökkent működése)
- vérmérgezés (szepszis)
Ha az infúzió alkalmazása során láz, bőrkiütés, duzzanat, nehézlégzés, hidegrázás, izzadás, émelygés vagy hányás jelentkezik, azonnal szóljon a gondozását végző egészségügyi szakembernek, mert ezeket a tüneteket allergiás reakció vagy a készítmény túladagolása is okozhatja.
Kezelőorvosa rendszeresen ellenőrizheti a vérképét, a májfunkciós és egyéb értékeit.
Gyermekek és serdülők
A SmofKabiven Peripheral nem alkalmazható újszülöttek vagy 2 évesnél fiatalabb gyermekek esetében. A SmofKabiven Peripheral 2‑16/18 éves gyermekeknek adható.
Egyéb gyógyszerek és a SmofKabiven Peripheral
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Terhesség és szoptatás
A SmofKabiven Peripheral terhesség vagy szoptatás alatti alkalmazására vonatkozóan nincsenek adatok. Ezért SmofKabiven Peripheral csak akkor adható terhesség vagy szoptatás alatt, ha azt kezelőorvosa feltétlenül szükségesnek találja. A SmofKabiven Peripheral terhesség vagy szoptatás alatti alkalmazása során az orvos utasításait be kell tartani.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Nem értelmezhető, mivel a készítményt kórházi kezelés során alkalmazzák.
3. Hogyan kell alkalmazni a SmofKabiven Peripheral‑t?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát.
Kezelőrvosa az infúzió adagját egyedileg, az Ön testtömegének és táplálékigényének megfelelően fogja meghatározni. A SmofKabiven Peripheral‑t egészségügyi szakember adja be Önnek.
Ha az előírtnál több SmofKabiven Peripheral‑t alkalmazott
Nem valószínű, hogy erre sor kerülhet, mivel a SmofKabiven Peripheral-t egészségügyi szakember fogja beadni Önnek.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Gyakori (10-ből legfeljebb 1 beteget érint): a testhőmérséklet kismértékű emelkedése. Az infúzió beadási helyén a felszíni perifériás véna gyulladása alakulhat ki.
Nem gyakori (100-ból legfeljebb 1 beteget érint): a májból származó összetevők magas szintje a vérben (plazmában), étvágytalanság, émelygés, hányás, hidegrázás, szédülés és fejfájás.
Ritka (1000-ből legfeljebb 1 beteget érint): alacsony vagy magas vérnyomás, nehézlégzés, szapora szívverés (tahikardia). Túlérzékenységi reakciók (amely olyan tüneteket okozhat, mint duzzanat, láz, vérnyomásesés, bőrkiütés, csalánkiütés (kiemelkedő piros terület), bőrpír, fejfájás). Hideg- vagy melegérzet. Sápadtság. Világoskéken elszíneződött ajkak és bőr (a vérben lévő túl kevés oxigén okozza). Nyak-, hát-, csont- mellkasi- és ágyéki fájdalom.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a SmofKabiven Peripheral‑t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Legfeljebb 25°C-on, a külső védőcsomagolásban tárolandó. Nem fagyasztható!
A címkén, a zsákon és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a SmofKabiven Peripheral?
|
A készítmény hatóanyagai g/1000 ml
|
Egyéb összetevők: glicerin, tisztított fojás-foszfolipidek, all‑rac‑ alfa-tokoferol, nátrium‑hidroxid (pH beállításához), nátrium‑oleát, ecetsav (pH beállításához) és injekcióhoz való víz.
Milyen a SmofKabiven Peripheral készítmény külleme és mit tartalmaz a csomagolás?
A glükóz és aminosav oldat tiszta és színtelen vagy halványsárga, részecskéktől mentes. A zsíremulzió fehér és homogén.
Kiszerelések:
4×1026 ml
4×1448 ml
3×1904 ml (Excel zsák)
4×1904 ml (Biofine zsák)
A forgalomba hozatali engedély jogosultja:
Fresenius Kabi AB, SE-751 74, Uppsala, Svédország
Gyártó:
Fresenius Kabi AB, SE-751 74.
Uppsala, Svédország
Fresenius Kabi Austria GmbH
Hafnerstrasse 36
8055 Graz, Ausztria
Ezt a gyógyszert az Európai Gazdasági Térség tagállamaiban az alábbi neveken engedélyezték:
|
Ausztria (AT) |
SmofKabiven perifer |
|
Belgium (BE) |
SmofKabiven Perifeer |
|
Bulgária (BG) |
SmofKabiven Peripheral |
|
Ciprus (CY) |
SmofKabiven Peripheral |
|
Csehország (CZ) |
SmofKabiven Peripheral |
|
Dánia (DK) |
SmofKabiven Peripheral |
|
Egyesült Királyság (UK) |
SmofKabiven Peripheral |
|
Észtország (EE) |
SmofKabiven Peripheral |
|
Finnország (FI) |
SmofKabiven Perifer |
|
Görögország (EL) |
SmofKabiven Peripheral |
|
Hollandia (NL) |
SmofKabiven Perifeer |
|
Írország (IE) |
SmofKabiven Peripheral |
|
Lengyelország (PL) |
SmofKabiven Peripheral |
|
Lettország (LT) |
SmofKabiven Peripheral |
|
Litvánia (LV) |
SmofKabiven Peripheral |
|
Luxemburg (LU) |
SmofKabiven perifer |
|
Magyarország (HU) |
SmofKabiven Peripheral |
|
Németország (DE) |
SmofKabiven perifer |
|
Norvégia (NO) |
SmofKabiven Peripheral |
|
Portugália (PT) |
SmofKabiven Peripheral |
|
Románia (RO) |
SmofKabiven Peripheral |
|
spanyolország (ES) |
SmofKabiven Periférico |
|
Szlovákia (SK) |
SmofKabiven Peripheral |
|
Szlovénia (SI) |
SmofKabiven Peripheral |
OGYI-T-20845/01 (4×1206 ml) Excel zsák
OGYI-T-20845/02 (3×1904 ml) Excel zsák
OGYI-T-20845/03 (4×1206 ml) Biofine zsák
OGYI-T-20845/04 (4×1904 ml) Biofine zsák
OGYI-T-20845/05 (4×1448 ml) Biofine zsák
OGYI-T-20845/06 (4×1448ml) Excel zsák
A betegtájékoztató legutóbbi felülvizsgálatának dátuma: 2016. május
------------------------------------------------------------------------------------------------------------------------------
Az alábbi információk kizárólag egészségügyi szakembereknek szólnak:
Figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések
A túl gyors infúziós sebességgel összefüggő kockázatok elkerülésére, javasolt folyamatos és jól kontrollált infúziót alkalmazni, amennyiben lehetséges volumetrikus pumpa alkalmazásával.
Bármely perifériás véna használata esetén fokozott a fertőzés kockázata, ezért a katéter behelyezése és a vele kapcsolatos tevékenységek alkalmával a kontamináció elkerülése érdekében az aszepszis szabályait szigorúan be kell tartani.
A szérum glükóz- és elektrolitszintek, az ozmolaritás, valamint a folyadék- és sav-bázis‑egyensúly és a májenzimek rendszeres mérése szükséges.
Anafilaxiás reakcióra utaló bármilyen jel vagy tünet (például láz, hidegrázás, bőrkiütés vagy nehézlégzés) esetén az infúzió adását azonnal fel kell függeszteni.
A pszeudoagglutináció veszélye miatt a SmofKabiven Peripheral-t nem szabad ugyanazon az infúziós szereléken keresztül vérrel egyszerre adni.
Perifériás alkalmazás esetén előfordulhat thrombophlebitis. Az infúzió beadási helyét naponta kell ellenőrizni a thrombophlebitis lokális tüneteinek észrevétele miatt.
Az alkalmazás módja
Intravénás alkalmazásra, infúzió perifériás vagy centrális vénába.
A teljes parenterális táplálás megvalósítása érdekében kiegészítésként nyomelemeket, vitaminokat és esetleg elektrolitokat (számításba véve a készítményben egyébként is megtalálható elektrolitokat) kell adni a beteg igényeinek megfelelően.
Adagolás
Felnőttek
Dózis
A 20-40 ml SmofKabiven Peripheral/ttkg/nap dózis 0,6‑1,3 g aminosav/ttkg/nap (megfelel 0,10‑0,20 g nitrogén/ttkg/nap mennyiségnek) és 14‑28 kcal/ttkg/nap teljes energia (11‑22 kcal/ttkg/nap nem‑fehérjéből származó energia) bevitelét biztosítja.
Az infúzió sebessége
Az infúzió maximális sebessége glükózra vonatkoztatva 0,25 g/ttkg/óra, aminosavra vonatkoztatva 0,1 g/ttkg/óra, lipidre vonatkoztatva pedig 0,15 g/ttkg/óra.
Az infúzió sebessége nem haladhatja meg a 3,0 ml/ttkg/órát (ami megfelel 0,21 g glükóznak, 0,10 g aminosavnak és 0,08 g lipidnek testtömeg-kilogrammonként és óránként). Az infúzió beadásának ajánlott időtartama 12-24 óra.
A maximális napi dózis:
A maximális napi dózis a beteg klinikai állapotától függ, és napról napra is változhat. Az ajánlott maximális napi adag 40 ml/ttkg/nap.
Gyermekek és serdülők
Gyermekek (2-11 év)
Dózis
A legfeljebb 40 ml/ttkg/nap adagot rendszeresen a gyermekek szükségleteihez kell igazítani, melyek nagyobb mértékben térnek el egymástól, mint felnőttek esetében.
Az infúzió sebessége
Az infúzió javasolt maximális sebessége 3,0 ml/ttkg/óra (ami megfelel 0,10 g aminosavnak, 0,21 g glükóznak és 0,08 g lipidnek testtömeg-kilogrammonként és óránként).
Az infúzió beadásának ajánlott időtartama 12-24 óra.
Az ajánlott maximális napi adag mellett az infúzió időtartama nem lehet 13 óránál kevesebb, és az ajánlott maximális infúziós sebességet nem szabad túllépni, csak kivételes esetekben.
A maximális napi dózis
A maximális napi dózis a beteg klinikai állapotától függ, és akár napról napra is változhat. Az ajánlott maximális napi adag 40 ml/ttkg/nap.
Serdülők (12‑16/18 év)
Serdülőknél a SmofKabiven Peripheralt ugyanúgy lehet alkalmazni, mint a felnőtteknél.
Elővigyázatosság a használat során
Kizárólag sértetlen csomagolású készítmény használható fel.
A készítményt csak akkor szabad felhasználni, ha az aminosav- és glükóz oldatok tiszták és színtelenek, vagy kissé sárgák, a lipidemulzió pedig fehér és homogén. A három különálló rekesz tartalmát az infúzió alkalmazása és mielőtt bármilyen adalék ‑ az adalékcsatlakozón keresztül történő – hozzáadása előtt össze kell keverni.
A hegesztések felnyílása után a zsákot néhány alkalommal meg kell fordítani a homogén elegy biztosítása céljából, amelyben a fázisok szétválásának semmi jele nem található.
Kizárólag egyszeri alkalmazásra. Az összes megmaradt infúziós keveréket meg kell semmisíteni.
Kompatibilitás
Csak olyan gyógyszer- vagy tápoldatok adhatók a SmofKabiven Peripheral-hoz, amelyek kompatibilitása bizonyított. Különböző adalékanyagok kompatibilitása és a különböző keverékek tárolási ideje kérésre rendelkezésre áll.
Az adalékanyagok hozzáadását aszeptikus körülmények között kell végezni.
A három rekesz összekevert, beadásra kész elegye 25°C hőmérsékleten, 36 órán keresztül kémiailag és fizikailag bizonyítottan stabil marad. Mikrobiológiai szempontból a készítményt azonnal fel kell használni. Amennyiben nem kerül azonnal felhasználásra, a felhasználást megelőző tárolás idejéért és annak körülményeiért a felhasználó a felelős, de az normál körülmények között 2‑8°C hőmérsékleten nem lehet hosszabb, mint 24 óra.
Mikrobiológiai szempontból a készítményt az adalékanyagokkal történő összekeverés után azonnal fel kell használni. Amennyiben nem kerül azonnal felhasználásra, a felhasználást megelőző tárolás idejéért és annak körülményeiért a felhasználó a felelős, de az normál körülmények között 2‑8°C hőmérsékleten nem lehet hosszabb, mint 24 óra.
Használati utasítás
Excel zsák
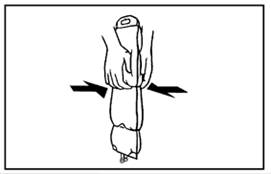
1. A külső védőcsomagolás eltávolításához tartsa a zsákot függőlegesen és tépje le a bemetszéstől a felső széléig, majd egyszerűen tépje fel a hosszú oldalt, vegye le a műanyag csomagolást és dobja ki az oxigén‑megkötővel együtt.
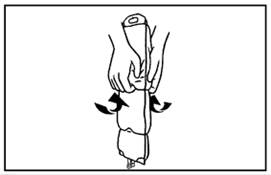
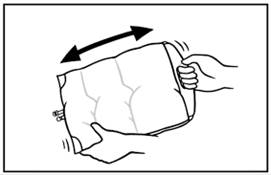
2. A zsák tartalmának összekeveréséhez helyezze ujjbegyeit a felső rekesz hegesztéséhez, ahogy a kép mutatja.

|
3. Markolja meg a felső rekesz oldalait az ujjbegyeivel és a hüvelykujjával, majd gyengéden addig görgesse ujjperceit egyszerre, amíg a hegesztés fel nem szakad. |
Alternatív eljárás (3): Helyezze a zsákot egy sima felületre. Csavarja fel a fogantyú segítségével, amíg a hegesztések fel nem nyílnak. Keverje össze alaposan a zsák tartalmát a zsák megfordításával. |
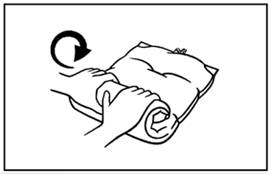
4. A hegesztés még fel nem nyílt részei gyengéd mozdulatokkal szétválaszthatóak.
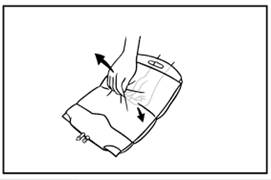
5. Az alsóbb hegesztések felnyitásához ugyanazt a módszert alkalmazza, mint amit fentebb leírtunk. A zsák tartalmának megfelelő összekeveréséhez gyengéden fordítsa meg a zsákot néhány alkalommal egyik végétől a másikig.
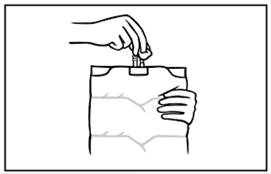
6. Mielőtt bármilyen adalékot injektálna, a bevezető csatlakozást fertőtlenítővel tisztítsa meg.
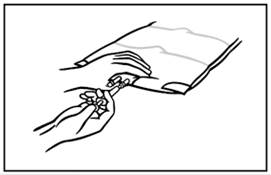
7. Tartsa szilárdan a bevezető csatlakozást. Teljesen vezesse be a tűt és injektálja az ismert kompatibilitású adalékokat az injektálási hely középpontján át. Minden adalék hozzáadása közben alaposan keverje össze a zsák tartalmát többszöri forgatással.
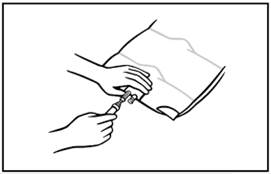
8. Használjon nem-szellőző infúziós szereléket, vagy zárja be a légbeeresztőt a szellőző szereléken. Távolítsa el a szerelék csatlakozás fedelét felfelé húzva a gyűrűt. Tartsa szilárdan az infúziós szerelék csatlakozó alapját. Az infúziós szerelék hegyét illessze be a csatlakozóba. Csavaró és nyomó mozdulattal szúrja át a membránt. Az infúziós szerelék hegyének teljes beszúrása biztosítja a szerelék megfelelő rögzítését.
Biofine zsák
Biofine zsák leírása:
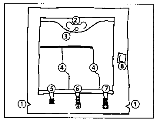
1. Bevágások a védőcsomagoláson
2. Fogantyú
3. Nyílás a felfüggesztéshez
4. Felszakítható hegesztések
5. Vakcsatlakozó (csak gyártáshoz használatos)
6. Adalék csatlakozó
7. Infúziós szerelék csatlakozó
8. Oxigén‑megkötő
|
1. A külső csomagolás eltávolítása • A külső csomagolás eltávolításához tartsa a zsákot egyenesen és tépje le a jelöléstől a felső széléig, (A), • majd egyszerűen tépje fel a hosszú oldalt, vegye le a műanyag csomagolást és dobja ki az oxigén‑megkötővel együtt (B).
|
|
|
2. Összekeverés • Helyezze a zsákot vízszintes felületre. • Tekerje fel a zsákot először jobb kézzel szorosan a fogantyú felől (a zsír felőli oldalról) a csatlakozók irányába, majd bal kézzel erőteljes nyomást alkalmazzon, míg a függőleges hegesztések felnyílnak. A függőleges hegesztések a folyadékra alkalmazott nyomás hatására felnyílnak. A hegesztések a külső csomagolás eltávolítása nélkül is felnyílnak. Figyelmeztetés: A zsák kinyitása során a vízszintes hegesztés zárva marad; így is teljes az összekeverés.
|
|
|
• Keverje össze a három kamra tartalmát úgy, hogy háromszor forgassa meg a zsákot, míg a tartalma teljesen összeelegyedik.
|
|
|
3. Az előkészítés befejezése • Helyezze a zsákot ismét vízszintes felületre. Közvetlenül az adalékok hozzáadása előtt törje le a fehér színű csatlakozó garanciazáras záróelemét (A). Figyelmeztetés: Az adalék csatlakozó membránja steril. • Tartsa szilárdan az adalékcsatlakozót. Szúrja át a csatlakozó membránját, injektálja az (ismert kompatibilitású) adalékokat az injektálási hely középpontján át. • Minden adalék hozzáadása után alaposan keverje össze a zsákot, háromszor megforgatva. A fecskendőhöz használt tű mérete 18-23 G legyen és a tű hossza max. 40 mm.
|
|
|
• Közvetlenül az infúziós szerelék csatlakozása előtt törje le a kék színű csatlakozó garanciazáras záróelemét. (A). Figyelmeztetés: Az infúziós szerelék csatlakozójának membránja steril. • Használjon nem-szellőző infúziós szereléket, vagy zárja be a légbeeresztőt a szellőző szereléken. • Tartsa szilárdan a csatlakozót. • Az infúziós szerelék hegyét teljes hosszában szúrja át a csatlakozó membránján. Az infúziós szerelék hegyének teljes beszúrása biztosítja a szerelék megfelelő rögzítését. Figyelmeztetés: Az infúziós szerelék csatlakozójának belső része steril.
|
|
|
4. A zsák felfüggesztése • Függessze fel a zsákot a fogantyú alatt lévő nyíláson át.
|
|